Teorija modelov pasov in primeri
The teorija pasov je tista, ki definira elektronsko strukturo trdnega telesa kot celote. Uporablja se lahko za katerokoli vrsto trdne snovi, vendar je v kovinah, kjer se odražajo njegovi največji uspehi. V skladu s to teorijo je kovinska vez posledica elektrostatične privlačnosti med pozitivno nabitimi ioni in mobilnih elektronov v kristalu..
Zato ima kovinski kristal »morje elektronov«, ki lahko razloži njegove fizikalne lastnosti. Spodnja slika prikazuje kovinsko povezavo. Vijolične pike elektronov se delokalizirajo v morju, ki obdaja pozitivno nabite kovinske atome.

"Morje elektronov" se oblikuje iz posameznih prispevkov vsakega atoma kovine. Ti prispevki so njegove atomske orbitale. Kovinske konstrukcije so na splošno kompaktne; bolj kompaktne so, večje so interakcije med atomi.
Posledica tega je, da se njihove atomske orbitale prekrivajo in ustvarjajo zelo ozke molekularne orbitale v energiji. Morje elektronov je torej le velik niz molekularnih orbitalov z različnimi razponi energij. Razpon teh energij sestavljajo tako imenovane energijske pasove.
Ti pasovi so prisotni v katerem koli območju kristala, zato ga obravnavamo kot celoto, od koder sledi definicija te teorije..
Indeks
- 1 Model energijskih pasov
- 1.1 Fermijev nivo
- 2 Polprevodniki
- 2.1 Lastni in zunanji polprevodniki
- 3 Primeri uporabne pasovne teorije
- 4 Reference
Model energijskih pasov

Ko je orbitalna sila kovinskega atoma v interakciji s sosednjo kovino (N = 2), nastanejo dve molekularni orbitali: ena vez (zeleni pas) in ena proti povezavi (temno rdeč pas).
Če je N = 3, so sedaj nastale tri molekularne orbitale, od katerih je srednja (črna črta) neobvezujoča. Če je N = 4, se oblikujejo štiri orbitale in tista z največjim veznim značajem in tista z največjim proti-zmrzovalnim značajem..
Razpon energije, ki je na voljo za molekularne orbitale, se širi, ko kovinski atomi kristala zagotavljajo svoje orbitale. Posledica tega je tudi zmanjšanje energijskega prostora med orbitali, do te mere, da se zgostijo v pasu.
Ta pas, sestavljen iz orbitalov, ima regije z nizko energijo (zelene in rumene barve) in visoko energijo (tiste oranžne in rdeče barve). Njihove energetske skrajnosti imajo nizko gostoto; vendar je večina molekularnih orbitalov (bela črta) koncentrirana v središču.
To pomeni, da elektroni "tečejo hitreje" skozi središče pasu kot na svojih koncih.
Fermijev nivo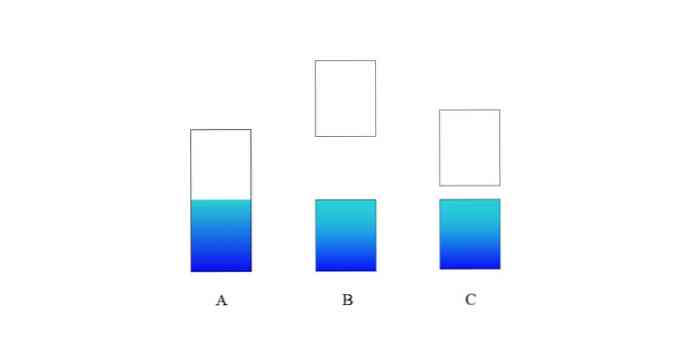
To je najvišje energetsko stanje, ki ga zasedajo elektroni v trdni snovi pri absolutni ničelni temperaturi (T = 0 K).
Ko je pas zgrajen, začnejo elektroni zasedati vse svoje molekularne orbitale. Če ima kovina enojni valentni elektron (i)1), vsi elektroni v njenem kristalu zasedajo polovico traku.
Druga nezasedena polovica je znana kot vozni pas, pas, poln elektronov, pa se imenuje valenčni pas.
Na zgornji sliki A je značilen valenčni pas (modri) in prevodni pas (bel) za kovino. Modra mejna črta označuje raven Fermija.
Ker imajo kovine tudi p-orbitale, se združujejo na enak način, da izvirajo p-pas (bela)..
V primeru kovin so pasovi s in p zelo energijski. To omogoča njihovo prekrivanje, s čimer spodbuja elektrone iz valenčnega pasu v prevodni pas. To se zgodi tudi pri temperaturah malo nad 0 K.
Za prehodne kovine in od obdobja 4 navzdol je mogoče oblikovati tudi pasove.
Raven Fermi glede na prevodni pas je zelo pomembna za določitev električnih lastnosti.
Na primer, kovina Z z Fermijevo ravnjo, ki je zelo blizu prevodnemu pasu (najbližji prazni pas v energiji), ima višjo električno prevodnost kot kovina X, v kateri je Fermijev nivo daleč od tega pasu..
Polprevodniki
Električna prevodnost je sestavljena iz migracije elektronov iz valenčnega pasu v prevodni pas.
Če je energijska vrzel med obema pasovoma zelo velika, imamo izolacijsko trdno snov (kot pri B). Po drugi strani pa, če je ta vrzel relativno majhna, je trdna snov polprevodnik (v primeru C).
Soočeni s povišanjem temperature, elektroni v valenčnem pasu pridobijo dovolj energije za migracijo proti prevodnemu pasu. Rezultat tega je električni tok.
Pravzaprav je to kakovost trdnih snovi ali polprevodniških materialov: pri sobni temperaturi so izolatorji, pri visokih temperaturah pa so vodniki.
Lastni in zunanji polprevodniki

Lastni vodniki so tisti, pri katerih je energetska vrzel med valentnim pasom in prevodnim pasom dovolj majhna, da toplotna energija omogoča prehod elektronov..
Po drugi strani pa zunanji vodniki po elektronski strukturi po dopiranju z nečistočami, ki povečujejo njihovo električno prevodnost, kažejo spremembe. Ta nečistoča je lahko druga kovina ali nekovinski element.
Če ima nečistota več valentnih elektronov, lahko zagotovi donorski pas, ki služi kot most za prehod elektronov valentnega pasu v prevodni pas. Te trdne snovi so polprevodniki tipa n. Tukaj n označba prihaja iz "negativne".
Na zgornji sliki je donorski pas prikazan v modrem bloku tik pod voznim pasom (vrsta n)..
Po drugi strani, če ima nečistoč manj valentnih elektronov, zagotavlja akceptorski pas, ki skrajša energetsko vrzel med valenčnim pasom in voznim pasom..
Elektroni se najprej selijo v smeri tega pasu in pustijo "pozitivne luknje", ki se gibljejo v nasprotni smeri.
Ker ti pozitivni razponi označujejo prehod elektronov, je trdna snov ali material polprevodnik p-tipa..
Primeri uporabne pasovne teorije
- Pojasnite, zakaj so kovine svetle: njihovi mobilni elektroni lahko absorbirajo sevanje v širokem razponu valovnih dolžin, ko skočijo na višje energetske nivoje. Nato oddajajo svetlobo in se vrnejo na nižje nivoje voznega pasu.
- Kristalni silicij je najpomembnejši polprevodniški material. Če je del silicija dopiran s sledovi elementa skupine 13 (B, Al, Ga, In, Tl), postane polprevodnik p-tipa. Če je dopiran z elementom iz skupine 15 (N, P, As, Sb, Bi), postane polprevodnik tipa n.
- Svetleča dioda (LED) je skupni polprevodnik p-n. Kaj misliš s tem? Da ima material obe vrsti polprevodnikov, n in p. Elektroni migrirajo iz prevodnega pasu polprevodnika n-tipa v valenčni pas polprevodniškega p-tipa.
Reference
- Whitten, Davis, Peck & Stanley. Kemija (8. izd.). CENGAGE Learning, str. 486-490.
- Shiver & Atkins. (2008). Anorganska kemija (Fourth edition., Str. 103-107, 633-635). Mc Graw Hill.
- Ladja C. R. (2016). Bandska teorija trdnih snovi. Vzpostavljeno 28. aprila 2018, od: hyperphysics.phy-astr.gsu.edu
- Steve Kornić (2011). Prehajanje iz obveznic v pasove z vidika kemikov. Vzpostavljeno 28. aprila 2018, iz: chembio.uoguelph.ca
- Wikipedija. (2018). Zunanji polprevodnik. Pridobljeno 28. aprila 2018, z: en.wikipedia.org
- BYJU'S. (2018). Bandova teorija kovin. Vzpostavljeno 28. aprila 2018, od: byjus.com



