Struktura, lastnosti, sinteza in uporaba cikloheksena
The cikloheksen je alken ali ciklični olefin, katerega molekulska formula je C6H10. Sestoji iz brezbarvne tekočine, netopne v vodi in se meša z mnogimi organskimi topili. Zanj je značilna vnetljivost, v naravi pa se ponavadi nahaja v premogovem katranu..
Cikloheksen se sintetizira z delno hidrogenacijo benzena in z dehidracijo alkoholnega cikloheksanola; to je bolj zarjavela oblika. Podobno kot drugi cikloalkeni so podvrženi reakcijam elektrofilne adicije in prostim radikalom; na primer reakcija halogeniranja.
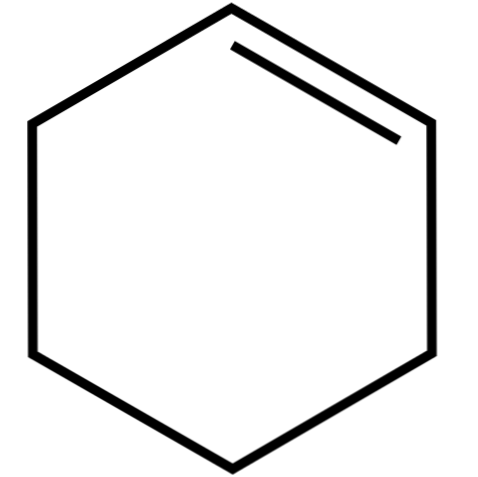
Ta ciklični alken (top image) tvori azeotropne zmesi (ki jih ni mogoče ločiti z destilacijo), z nižjimi alkoholi in ocetno kislino. V dolgotrajnem skladiščenju ni zelo stabilen, saj se razpade pod vplivom sončne svetlobe in ultravijoličnega sevanja.
Cikloheksen se uporablja kot topilo, zato ima številne aplikacije, kot so: stabilizator visoko oktanskih bencinov in za ekstrakcijo olj.
Najpomembnejše pa je, da cikloheksen služi kot vmesni material in surovina za proizvodnjo mnogih uporabnih spojin, med njimi: cikloheksanon, adipinska kislina, maleinska kislina, cikloheksan, butadien, cikloheksilkarboksilna kislina itd..
Indeks
- 1 Struktura cikloheksena
- 1.1 Med-molekularne interakcije
- 2 Lastnosti
- 2.1 Kemična imena
- 2.2 Molekularna teža
- 2.3 Fizični izgled
- 2.4 Vonj
- 2.5 Vrelišče
- 2.6 Tališče
- 2.7 Plamenišče
- 2.8 Topnost v vodi
- 2.9 Topnost v organskih topilih
- 2.10 Gostota
- 2.11 Gostota hlapov
- 2.12 Parni tlak
- 2.13 Samovžig
- 2.14 Razgradnja
- 2.15 Viskoznost
- 2.16 Toplota zgorevanja
- 2.17 Toplota izparevanja
- 2.18 Površinska napetost
- 2.19 Polimerizacija
- 2.20 Prag prahu
- 2.21 Refrakcijski indeks
- 2,22 pH
- 2.23 Stabilnost
- 2.24 Reakcije
- 3 Povzetek
- 4 Uporabe
- 5 Tveganja
- 6 Reference
Struktura cikloheksena
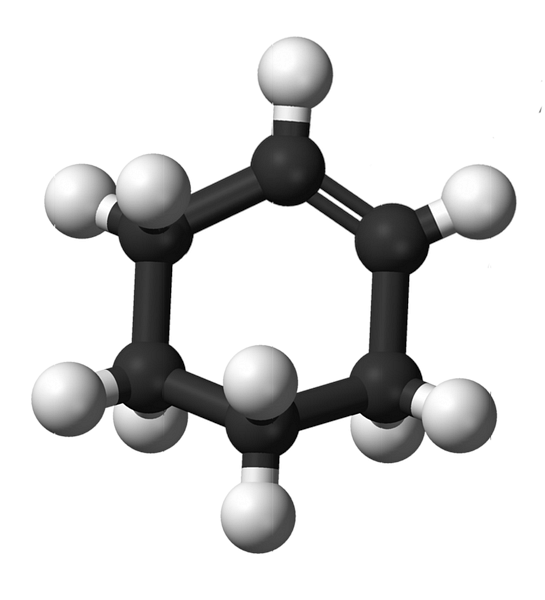
Struktura cikloheksena z modelom kroglic in palic je prikazana na zgornji sliki. Opazimo lahko šest ogljikov obroč in dvojno vez, obe nenasičenosti spojine. S tega vidika se zdi, da je obroč ravno; vendar sploh ni.
Za začetek so ogljiki dvojne vezi sp hibridizirani2, kar jim daje trigonsko geometrijo. Zato sta ta dva ogljika in tista, ki mejijo nanje, v isti ravnini; medtem ko sta dva ogljika na nasprotnem koncu (na dvojno vez) nad in pod omenjeno ravnino.
Spodnja slika popolnoma ponazarja, kar je bilo pravkar pojasnjeno.

Upoštevajte, da je črni pas sestavljen iz štirih ogljikovih atomov: dveh dvojnih vezi in drugih sosednjih. Izpostavljena perspektiva je tista, ki bi jo dobili, če bi gledalec postavil svoje oko pred dvojno vez. Vidimo lahko, da je ogljik nad in pod to ravnino.
Ker molekula cikloheksena ni statična, se bosta izmenjala dva ogljika: eden bo nižji, drugi pa se bo dvignil nad ravnino. Torej pričakujete, da se bo molekula obnašala.
Med-molekularne interakcije
Cikloheksen je ogljikovodik, zato njegove intermolekularne interakcije temeljijo na disperzijskih silah Londona..
To je zato, ker je molekula nepolarna, brez stalnega dipolnega momenta, in njena molekulska masa je faktor, ki največ prispeva k ohranjanju kohezivnosti v tekočini..
Prav tako dvojna vez poveča stopnjo interakcije, saj se ne more premikati z enako prožnostjo kot pri drugih ogljikovih atomih, kar daje prednost interakciji med sosednjimi molekulami. Zato ima cikloheksen nekoliko višje vrelišče (83 ° C) kot cikloheksan (81 ° C)..
Lastnosti
Kemična imena
Cikloheksen, tetrahidrobenzen.
Molekularna teža
82,146 g / mol.
Fizični izgled
Brezbarvna tekočina.
Vonj
Sladki vonj.
Vrelišče
83 ° C do 760 mmHg.
Tališče
-103,5 ° C.
Vžigalna točka
-7ºC (zaprta posoda).
Topnost v vodi
Skoraj netopen (213 mg / L).
Topnost v organskih topilih
Meša se z etanolom, benzenom, ogljikovim tetrakloridom, petroletrom in acetonom. Pričakuje se, da bo sposoben raztopiti nepolarne spojine, kot so nekateri alotropi premoga.
Gostota
0.810 g / cm3 pri 20 ° C.
Gostota pare
2,8 (glede na zrak, vzet kot enak 1).
Parni tlak
89 mmHg pri 25 ° C.
Samovžig
244 ° C.
Razgradnja
Razgradi se v prisotnosti uranovih soli pod vplivom sončne svetlobe in ultravijoličnega sevanja.
Viskoznost
0,625 mPascal pri 25 ° C.
Toplota zgorevanja
3,751.7 kJ / mol pri 25 ° C.
Toplota izhlapevanja
30,46 kJ / mol pri 25 ° C.
Površinska napetost
26,26 mN / m.
Polimerizacija
Lahko se polimerizira pod določenimi pogoji.
Prag vonja
0,6 mg / m3.
Indeks refrakcije
1.4465 pri 20 ° C.
pH
7-8 pri 20 ° C.
Stabilnost
Cikloheksen med dolgotrajnim shranjevanjem ni zelo stabilen. Izpostavljenost svetlobi in zraku lahko povzroči nastajanje peroksidov. Prav tako je nezdružljiv z močnimi oksidacijskimi sredstvi.
Reakcije
-Cikloalkeni večinoma doživljajo reakcije adicije, tako elektrofilne kot proste radikale.
-Reagira z bromom in tvori 1,2-dibromocikloheksan.
-Hitro oksidira v prisotnosti kalijevega permanganata (KMnO4).
-Sposoben je proizvesti epoksid (cikloheksen oksid) v prisotnosti peroksibenzojske kisline..
Sinteza
Cikloheksen se proizvaja s kislinsko katalizo cikloheksanola:
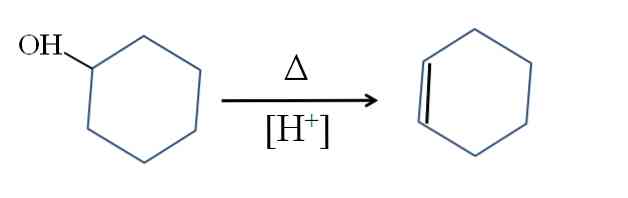
Simbol Δ predstavlja toploto, potrebno za pospeševanje izstopa OH skupine kot molekule vode v kislem mediju (-OH)2+).
Cikloheksen se proizvaja tudi z delnim hidrogeniranjem benzena; to pomeni, da dve njegovi dvojni vezi dodata molekulo vodika:
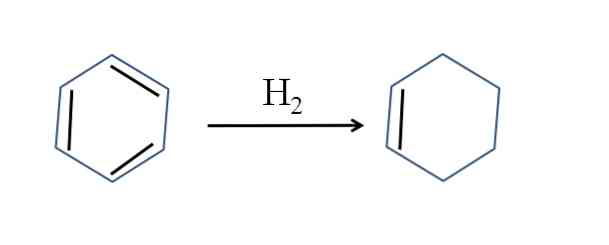
Čeprav se zdi, da je reakcija preprosta, zahteva velike pritiske H2 in katalizatorji.
Uporabe
-Uporabna je kot organsko topilo. Poleg tega je surovina za proizvodnjo adipinske kisline, adipin aldehida, maleinske kisline, cikloheksana in cikloheksilkarboksilne kisline..
-Uporablja se v proizvodnji cikloheksan klorida, spojine, ki se uporablja kot posrednik pri proizvodnji farmacevtskih izdelkov in dodatkov iz gume..
-Cikloheksen se uporablja tudi pri sintezi cikloheksanona, surovine za proizvodnjo zdravil, pesticidov, parfumov in barvil.
-Cikloheksen je vključen v sintezo aminocikloheksanola, spojine, ki se uporablja kot surfaktant in emulgator..
-Poleg tega se lahko cikloheksen uporablja za pripravo v laboratoriju butadiena. Slednja spojina se uporablja pri proizvodnji sintetične gume pri izdelavi avtomobilskih pnevmatik, uporablja pa se tudi v proizvodnji akrilnih plastik.
-Cikloheksen je surovina za sintezo lizina, fenola, policikloolefinske smole in dodatkov kavčuka.
-Uporablja se kot stabilizator visoko oktanskih bencinov.
-Vključena v sintezo vodotesnih premazov, filmov, odpornih na razpoke, in veznih veziv za premaze.
Tveganja
Cikloheksen ni zelo toksična spojina, lahko pa povzroči pordelost kože in oči s stikom. Vdihavanje lahko povzroči kašelj in zaspanost. Poleg tega lahko zaužitje povzroči zaspanost, težave z dihanjem in slabost.
Cikloheksen se slabo absorbira v prebavnem traktu, zato ni pričakovati resnih sistemskih učinkov zaradi zaužitja. Največji zaplet je njegova aspiracija dihal, ki lahko povzroči kemično pljučnico.
Reference
- Joseph F. Chiang in Simon Harvey Bauer. (1968). Molekularna struktura cikloheksena. J. Am.Chem.Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cikloheksen: nevarnosti, sinteza in struktura. Študija. Vzpostavljeno iz: study.com
- Morrison, R.T. in Boyd, R.N. (1987). Organska kemija (5ta Edition.). Uvodnik Addison-Wesley Iberoamericana.
- PubChem. (2019). Cikloheksen. Vzpostavljeno iz: pubchem.ncbi.nlm.nih.gov
- Kemijska knjiga. (2019). Cikloheksen. Vzpostavljeno iz: chemicalbook.com
- Podatkovna mreža za toksikologijo. (2017). Cikloheksen. Toxnet Vzpostavljeno iz: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). Strukturna formula za cikloheksen je. Vzpostavljeno iz: chemoxy.com


