Kemična struktura, lastnosti in uporaba natrijevega bromida (NaBr)
The natrijevega bromida je kemična vrsta, ki spada v soli anorganskega izvora. Njegova struktura je sestavljena iz bromo halogena in natrijevega kovinskega elementa v razmerju 1: 1. Njegova kemijska formula je NaBr in je v stanju trdne agregacije pri standardnih pogojih temperature in tlaka (25 ° C in 1 atm)..
Običajno ga lahko opazimo kot bel prašek in ga obravnavamo kot spojino kristaliničnega tipa, ki kaže tudi higroskopično obnašanje; to pomeni, da ima sposobnost absorbirati vlago iz okolice.

Podobno ima natrijev bromid fizikalne lastnosti, ki so zelo podobne drugim ionskim spojinam iste kovine: natrijevega klorida. Ta klorid je predstavljen kot NaCl, ki je bolj znan kot kuhinjska sol ali kuhinjska sol.
Ima veliko število uporab na različnih področjih znanosti; na primer, uporablja se pri proizvodnji različnih vrst zdravil (sedativi, hipnotiki, antikonvulzivi, med drugim), kot tudi v organski sintezi in celo pri fotografskih aplikacijah..
Indeks
- 1 Kemijska struktura
- 1.1 Kemijska sinteza
- 2 Lastnosti
- 3 Uporabe
- 4 Reference
Kemijska struktura
Kot je bilo že omenjeno, se natrijev bromid pojavlja v trdni fazi in ima, tako kot mnoge druge soli anorganske narave, kristalno strukturno konformacijo..
Ta kristalinična molekula, ki sestoji iz broma in vodikovega atoma, ima konformacijo kubičnega tipa s sredino na obrazih, kot so haloidne soli iste kovine (NaI, NaF in NaCl)..
Ta molekularna ureditev je strukturna osnova mnogih spojin, v katerih se urejanje izvaja tako, da je vsak ion v središču oktaedarske figure, kot je prikazano na naslednji sliki..
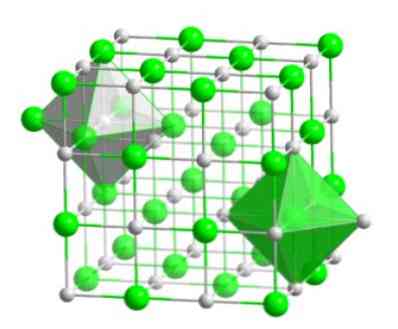
V tej vrsti kristala lahko vidite, kako ima vsak od ionov okoli šest drugih ionov, ki imajo nasprotni električni naboj, ki se nahajajo na koncih oktaedarske figure..
Tudi struktura te ionske snovi pomeni, da ima visoko tališče približno 747 ° C, saj je komercialno v dveh oblikah: brezvodna vrsta (brez vodnih molekul) in dihidrirana vrsta (z dvema vodnima molekulama v Strukturna formula (NaBr · 2H2O)), katerih tališča so različna.
Kemijska sinteza
Natrijev bromid nastane zaradi kemične reakcije med bromovodikom (BrH, vodikov halid v plinski fazi) in natrijevim hidroksidom (NaOH, močno bazo v trdni fazi in s higroskopičnimi lastnostmi)..
Na ta način se komercialno proizvaja z dodajanjem presežka broma k raztopini NaOH. To tvori zmes bromida / broma. Nato nastale produkte uparimo do suhega in obdelamo z ogljikom, da dobimo redukcijsko reakcijo bromatnega iona (BrO).3-) na bromidni ion (Br-).
Nevtralizacija
Podobno se lahko ta anorganska sol proizvaja tudi z nevtralizacijsko reakcijo natrijevega karbonata (Na2CO3) z bromično kislino (HBrO)3) po enakem postopku, kot je opisan zgoraj.
S sintezo se ta snov lahko proizvaja z reakcijo železa z bromom in vodo. Kot produkt te reakcije izvirajo vrste železa-železovega bromida.
Kasneje se je ta vrsta oblikovala (predstavljena kot FeBr2/ FeBr3) raztopimo v vodi in dodamo določeno količino natrijevega karbonata. Končno, raztopino filtriramo in spustimo skozi postopek uparjanja, da dobimo natrijev bromid.
Lastnosti
- Običajno se nahaja v stanju trdne agregacije v obliki belega prahu.
- Ima kristalno strukturo, z molekularno sestavo v obliki kocke, ki se nahaja na obrazih.
- Tališče te snovi je približno 747 ° C zaradi brezvodne oblike in 36 ° C za njeno dihidrirano obliko, ki kaže razgradnjo, preden se topi.
- Sestoji iz natrijevega iona (Na+) in bromidni ion (Br-z molsko maso ali molekulsko maso 102,89 g / mol.
- Njegovo vrelišče je precej visoko in opazujemo pri 1390 ° C (kar ustreza 1630 K).
- Topnost te vrste je okoli 94,32 g / 100 ml v vodi pri 25 ° C, s povečevanjem temperature.
- Ko se snov segreje do točke, kjer se razgradi, ta snov sprošča pline broma in natrijevega oksida, ki so strupeni.
- Gostota brezvodne oblike natrijevega bromida je 3,21 g / cm3, medtem ko je dihidratna spojina 2,18 g / cm3.
- Njegova topnost v alkoholu se šteje za zmerno, tako kot v drugih topilih, kot so piridin, amonijak in hidrazin.
- Ima netopnost proti acetonitrilu in acetonu.
Uporabe
- Na področju medicine se uporablja kot zdravilo za številna stanja, ki povzročajo epileptične napade, in kot terapijo za preprečevanje epilepsije pri bolnikih s sindromom Wolf-Hirschhorn, kot tudi pri sedativnem in hipnotičnem zdravljenju..
- V veterinarski medicini se uporablja pri psih, ki imajo epileptične napade zaradi neželenih učinkov zdravil, kot so fenobarbital ali primidon.
- Na področju naftne industrije se uporablja pri pripravi nekaterih tekočin različne gostote, ki se uporabljajo v naftnih vrtinah.
- Na področju bioloških raziskav so bile dokazane njene mikrobiocidne lastnosti; to pomeni, da se uporablja za nadzor razvoja različnih vrst bakterij.
- Pri nekaterih sintezah organskega tipa se ta sol anorganske narave uporablja za pripravo drugih vrst, ki jih sestavlja brom. Na primer, z reakcijo Finkelsteina dobimo nekaj alkil halidov z večjo reaktivnostjo, od katerih je bila nekoč precej uporabljena pri fotografiranju..
- Na področju čiščenja in dezinfekcije se natrijev bromid uporablja v kombinaciji s klorom za sanacijo velikih količin vode, kot so plavalni bazeni in jacuzzije..
Reference
- Wikipedija. (s.f.). Natrijev bromid. Vzpostavljeno iz en.wikipedia.org
- PubChem. (s.f.). Natrijev bromid. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Vabilo na organsko kemijo. Vzpostavljeno iz books.google.co.ve
- Science Direct. (s.f.). Natrijev bromid. Pridobljeno s sciencedirect.com
- Riviere, J. E. in Papich, M. G. (2009). Veterinarska farmakologija in terapevtiki. Vzpostavljeno iz books.google.co.ve


