Atomski model Bohrovih značilnosti, postulati, omejitve
The Borov atomski model je predstavitev atoma, ki ga je predlagal danski fizik Neils Bohr (1885-1962). Model navaja, da se elektroni gibljejo po orbiti na fiksni razdalji okoli atomskega jedra, kar opisuje enotno krožno gibanje. Orbite - ali ravni energije, kot jih je imenoval - so različne energije.
Vsakič, ko elektron spremeni orbito, oddaja ali absorbira energijo v fiksnih količinah, imenovanih "kvanti". Bohr je pojasnil spekter svetlobe, ki jo oddaja (ali absorbira) atom vodika. Ko se elektron premakne iz ene orbite v drugo proti jedru, se izgubi energija in svetloba, z valovno dolžino in energijskimi lastnostmi..

Bohr je oštevilčil energijske nivoje elektrona, glede na to, da je elektron bližje jedru, nižje je njegovo energetsko stanje. Na ta način, kolikor bolj je elektronov iz jedra, višja je raven energijske ravni in zato bo energetsko stanje višje..
Indeks
- 1 Glavne značilnosti
- 1.1 Temelji na drugih modelih in teorijah časa
- 1.2 Eksperimentalni dokazi
- 1.3 Elektroni obstajajo v energetskih nivojih
- 1.4 Brez energije ni gibanja elektrona
- 1.5 Število elektronov v vsaki plasti
- 1.6 Elektroni se vrtijo v krožnih orbitah brez sevalne energije
- 1.7 Dovoljene orbite
- 1.8 Energija, ki se oddaja ali absorbira v skokih
- 2 Postulati Bohrovega atomskega modela
- 2.1 Prvi postulat
- 2.2 Drugi postulat
- 2.3 Tretji postulat
- 3 Diagram energetskih ravni za vodikove atome
- 4 Tri glavne omejitve Bohrovega modela
- 5 zanimivih členov
- 6 Reference
Glavne značilnosti
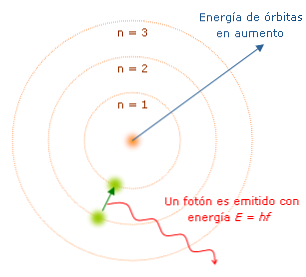
Značilnosti Bohrovega modela so pomembne, ker so določile pot k razvoju popolnejšega atomskega modela. Glavni so:
Temelji na drugih modelih in teorijah časa
Borov model je prvi vključil kvantno teorijo, ki jo podpira Rutherfordov atomski model, in ideje iz fotoelektričnega učinka Alberta Einsteina. Pravzaprav so bili Einstein in Bohr prijatelji.
Eksperimentalni dokazi
V skladu s tem modelom atomi absorbirajo ali oddajajo sevanje le, ko elektroni skočijo med dovoljenimi orbitami. Nemški fiziki James Franck in Gustav Hertz so leta 1914 pridobili eksperimentalne dokaze teh stanj.
Elektroni obstajajo v energijskih nivojih
Elektroni obkrožajo jedro in obstajajo na določenih energetskih nivojih, ki so diskretni in opisani v kvantnih številkah.
Energetska vrednost teh nivojev obstaja kot funkcija števila n, ki se imenuje glavno kvantno število, ki se lahko izračuna z enačbami, ki bodo podrobneje opisane kasneje..
Brez energije ni gibanja elektrona
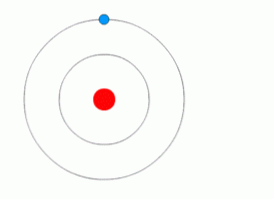
Zgornja ilustracija prikazuje elektron, ki naredi kvantne skoke.
Po tem modelu brez energije ni prenosa elektrona iz ene ravni na drugo, prav tako kot brez energije ni mogoče dvigniti predmeta, ki je padel, ali ločiti dva magneta..
Bohr je predlagal, da je kvant kot energija, ki jo potrebuje elektron, da preide iz ene ravni na drugo. Povedal je tudi, da se najnižja energetska raven, ki jo zaseda elektron, imenuje "osnovno stanje". "Razburjeno stanje" je bolj nestabilno stanje, ki je posledica prehoda elektrona v višjo energijsko orbitalo.
Število elektronov v vsaki plasti
Elektroni, ki se prilegajo v vsako plast, so izračunani z 2n2
Kemični elementi, ki so del periodnega sistema in so v istem stolpcu, imajo v zadnji plasti enake elektrone. Število elekronov v prvih štirih slojih bi bilo 2, 8, 18 in 32.
Elektroni se vrtijo v krožnih orbitah brez sevalne energije
Po Borovu prvem postulatu elektroni opisujejo krožne orbite okoli jedra atoma brez sevalne energije.
Orbite so dovoljene
V skladu z Bohrovim drugim postulatom so edini dovoljeni orbiti za elektron tisti, pri katerih je kotni moment L elektrona celo število, ki je večkratno Planckove konstante. Matematično je izraženo takole:
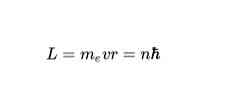
Energija, ki se oddaja ali absorbira v skokih
Po tretjem postulatu bi elektroni v skokih iz ene orbite v drugo oddajali ali absorbirali energijo. Pri skoku orbite se oddaja ali absorbira foton, katerega energija je matematično predstavljena:
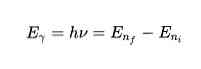
Postulati Bohrovega atomskega modela
Bohr je dal kontinuiteto planetnemu modelu atoma, po katerem se elektroni vrtijo okrog pozitivno nabitega jedra, pa tudi planetov okoli Sonca..
Vendar ta model izpodbija enega izmed postulatov klasične fizike. V skladu s tem naj bi delci z električnim nabojem (kot elektron), ki se premika po krožni poti, neprekinjeno izgubljali energijo z oddajanjem elektromagnetnega sevanja. Pri izgubi energije mora elektron slediti spirali do padca v jedro.
Bohr je nato domneval, da zakoni klasične fizike niso najbolj primerni za opis stabilnosti, ki jo opazimo v atomih, in je predstavil naslednje tri postulate:
Prvi postulat
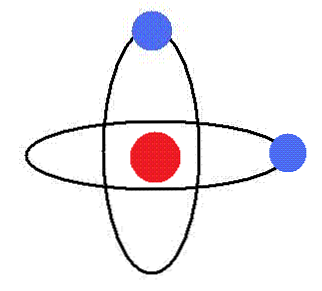
Elektron se vrti okoli jedra v krožnih orbitah, brez sevanja energije. V teh orbitah je orbitalna vrtilna količina konstantna.
Za elektrone atoma so dovoljene samo orbite določenih polmerov, ki ustrezajo določenim energijskim nivojem.
Drugi postulat
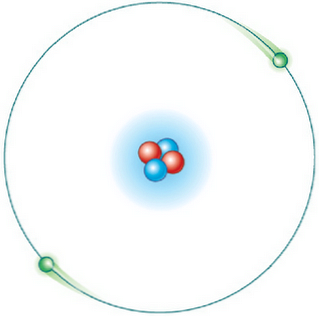
Vse orbite niso možne. Toda ko je elektron v orbiti, ki je dovoljena, je v stanju specifične in konstantne energije in ne oddaja energije (stacionarna energijska orbita).
Na primer, v atomu vodika so dovoljene energije za elektron dane z naslednjo enačbo:
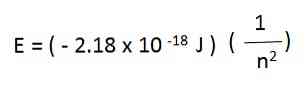
Elektronske energije vodikovega atoma, ki nastanejo iz zgornje enačbe, so negativne za vsako vrednost n. S povečevanjem n je energija manj negativna in se zato povečuje.
Če je n dovolj velik, na primer n = ∞ - je energija nič in pomeni, da je bil sproščen elektron in ioniziran atom. To stanje brez energije hrani večjo energijo kot države z negativnimi energijami.
Tretji postulat
Elektron se lahko spremeni iz stacionarne energetske orbite v drugo z oddajanjem ali absorbiranjem energije.
Energija, ki se oddaja ali absorbira, bo enaka energijski razliki med obema državama. Ta energija E je v obliki fotona in je podana z naslednjo enačbo:
E = h ν
V tej enačbi E je energija (absorbirana ali emitirana), h je Planckova konstanta (njena vrednost je 6,63 x 10)-34 joule-seconds [J-s]) in ν je frekvenca svetlobe, katere enota je 1 / s.
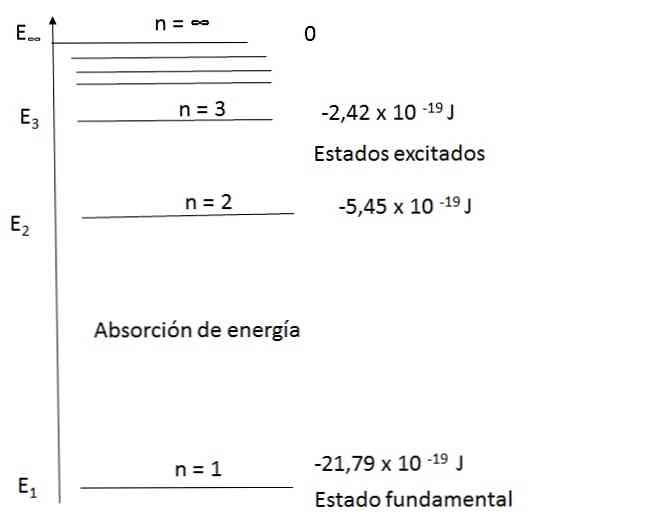
Diagram energetskih nivojev vodikovih atomov
Bohrov model je lahko zadovoljivo pojasnil spekter vodikovega atoma. Na primer, v območju valovnih dolžin vidne svetlobe je emisijski spekter vodikovega atoma naslednji:
Poglejmo, kako lahko izračunamo frekvenco nekaterih opazovanih svetlobnih pasov; na primer rdeča barva.
Z uporabo prve enačbe in zamenjavo n za 2 in 3 dobimo rezultate, ki se pojavijo v diagramu.

To je:
Za n = 2, E2 = -5,45 x 10-19 J
Za n = 3, E3 = -2,42 x 10-19 J
Nato je mogoče izračunati razliko v energiji za dve ravni:
E = E3 - E2 = (-2,42 - (- 5,45)) x 10 - 19 = 3.43 x 10 - 19 J
Po enačbi, razloženi v tretjem predpostavki ΔE = h ν. Nato lahko izračunate ν (frekvenca svetlobe):
ν = ΔE / h
To je:
ν = 3,43 x 10-19 J / 6,63 x 10-34 J-s
ν = 4,56 x 1014 s-1 ali 4,56 x 1014 Hz
Je λ = c / ν in hitrost svetlobe c = 3 x 10 8 m / s, valovna dolžina je podana z:
λ = 6.565 x 10 - 7 m (656,5 nm)
To je vrednost valovne dolžine rdečega pasu, opaženega v spektru vodikovih linij.
3 glavne omejitve Bohrovega modela
1 - Prilagodi se spektru vodikovega atoma, ne pa tudi spektrom drugih atomov.
2 - undulacijske lastnosti elektrona niso predstavljene v opisu tega kot majhen delček, ki se vrti okoli atomskega jedra..
3- Bohr ne pojasni, zakaj klasični elektromagnetizem ne velja za njegov model. Zato elektroni ne oddajajo elektromagnetnega sevanja, ko so v stacionarni orbiti.
Zanimivi izdelki
Atomski model Schrödingerja.
Atomski model Broglie.
Atomski model Chadwicka.
Atomski model Heisenberga.
Atomski model Perrina.
Atomski model Thomsona.
Atomski model Daltona.
Atomski model Diracovega Jordana.
Atomski model Demokrita.
Reference
- Brown, T.L. (2008). Kemija: osrednja znanost. Zgornja Saddle River, NJ: Pearson Prentice Hall
- Eisberg, R., & Resnick, R. (2009). Kvantna fizika atomov, molekul, trdnih snovi, jeder in delcev. New York: Wiley
- Atomski model Bohr-Sommerfelda. Vzpostavljeno iz: fisquiweb.es
- Joesten, M. (1991). Svet kemije Philadelphia, Pa.: Saunders College Publishing, str.
- Modèle de Bohr de l'atome d'hydrogène. Vzpostavljeno iz fr.khanacademy.org
- Izlar, K. Retrospektiva sur l'atome: le modèle de Bohr cent in ans. Vzpostavljeno iz: home.cern



