Značilnosti in omejitve Brogliejevega atomskega modela
The Brogliejev atomski model je predlagal francoski fizik Louis Broglie leta 1924. V svoji doktorski disertaciji je Broglie uveljavil valovitost dvojnosti elektronov, ki so postavili temelje valovne mehanike. Broglie je objavil pomembna teoretična spoznanja o valpuskularni naravi snovi na atomski skali.
Kasneje so znanstvenika Clinton Davisson in Lester Germer eksperimentalno dokazali Brogliejeve izjave leta 1927. Teorija Brogliejeve elektronske valove temelji na Einsteinovem predlogu o valovnih lastnostih svetlobe pri kratkih valovnih dolžinah..
Broglie je napovedal možnost, da ima materija podobna vedenja kot svetloba, in predlagala podobne lastnosti v subatomskih delcih, kot so elektroni..
Električni naboji in orbite omejujejo amplitudo, dolžino in frekvenco vala, ki ga opisujejo elektroni. Broglie je pojasnil gibanje elektronov okoli atomskega jedra.
Indeks
- 1 Značilnosti Brogliejevega atomskega modela
- 2 Davissonov in Germerjev eksperiment
- 3 Omejitve
- 4 Zanimivi členi
- 5 Reference
Značilnosti Brogliejevega atomskega modela
Da bi razvil svoj predlog, je Broglie začel z načelom, da imajo elektroni dvojno naravo med valom in delci, podobno svetlobi.
V tem smislu je Broglie naredil primerjavo med obema pojavoma in na podlagi enačb, ki jih je Einstein razvil za proučevanje valovne narave svetlobe, navedel naslednje:
- Celotna energija fotona in posledično celotna energija elektrona izhaja iz produkta frekvence vala in konstante Planka (6.62606957 (29) × 10). -34 Jules x s), kot je podrobno opisano v naslednjem izrazu:
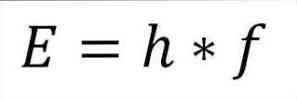
V tem izrazu:
E = energija elektronov.
h = Konstanta dlani.
f = frekvenca vala.
- Linearni moment fotona in s tem elektrona je obratno sorazmeren z valovno dolžino, obe velikosti pa sta povezani s konstanto Plank:
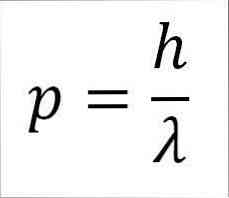
V tem izrazu:
p = linearni moment elektrona.
h = Konstanta dlani.
λ = valovna dolžina.
- Linearni moment je zmnožek mase delca s hitrostjo, ki jo ima delček med premikom.
Če se prejšnji matematični izraz prestrukturira kot funkcija valovne dolžine, imamo naslednje:
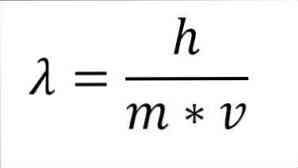
V navedenem izrazu:
λ = valovna dolžina.
h = Konstanta dlani.
m = masa elektrona.
v = hitrost elektronov.
Ker je h, Plankova konstanta, majhna vrednost, je tudi valovna dolžina λ. Zato je možno trditi, da se valovne lastnosti elektronov pojavljajo le na atomski in subatomski ravni.
- Broglie temelji tudi na postulatih Bohrovega atomskega modela. Glede na slednje so orbite elektronov omejene in so lahko le mnogokratniki celih števil. Tako:
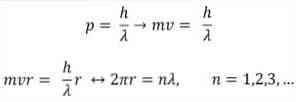
Kje:
λ = valovna dolžina.
h = Konstanta dlani.
m = masa elektrona.
v = hitrost elektronov.
r = polmer orbite.
n = celo število.
V skladu z Bohrovim atomskim modelom, ki ga je Broglie sprejel kot podlago, če se elektroni obnašajo kot stojni valovi, so edine dovoljene orbite tiste, katerih polmer je enak integralnemu večkratniku valovne dolžine λ..
Zato vse orbite ne izpolnjujejo parametrov, ki so potrebni, da se elektron premika skozi njih. Zato lahko elektroni potujejo le v določenih orbitah.
Valovna teorija Brogliejevih elektronov je utemeljila uspeh Bohrovega atomskega modela, da bi razložila obnašanje posameznega elektrona vodikovega atoma..
Podobno je tudi osvetlilo, zakaj ta model ni ustrezal bolj kompleksnim sistemom, to je atomom z več kot enim elektronom.
Davissonov in Germerjev eksperiment
Eksperimentalna verifikacija Brogliejevega atomskega modela je potekala 3 leta po njeni objavi, leta 1927.
Ugledni ameriški fiziki Clinton J. Davisson in Lester Germer sta eksperimentalno potrdila teorijo valovne mehanike.
Davisson in Germer sta izvedla teste sipanja elektronskega žarka skozi kristal niklja in opazovala pojav difrakcije skozi kovinski medij..
Izvedeni poskus je obsegal naslednji postopek: \ t
- Na prvi stopnji je bil postavljen sklop z elektronskim žarkom, ki je imel znano začetno energijo.
- Napeljan je bil vir napetosti, ki je pospešil gibanje elektronov, kar je povzročilo potencialno razliko.
- Tok elektronskega žarka je bil usmerjen proti kovinskemu kristalu; v tem primeru nikelj.
- Izmerili smo število elektronov, ki so vplivali na nikljev kristal.
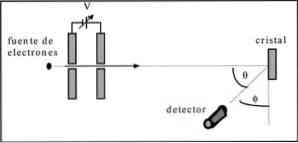
Na koncu poskusa sta Davisson in Germer ugotovila, da so elektroni razpršeni v različnih smereh.
S ponovitvijo eksperimenta z uporabo kovinskih kristalov z različnimi usmeritvami so znanstveniki odkrili naslednje:
- Disperzija elektronskega žarka skozi kovinski kristal je bila primerljiva s pojavom interference in difrakcije svetlobnih žarkov.
- Odsev elektronov na kristalu vpliva je opisal trajektorijo, ki naj bi teoretično opisala po teoriji elektronskih valov Broglie..
V sintezi je eksperiment Davissona in Germerja eksperimentalno dokazal dvojno valovno delce elektronov.
Omejitve
Brogliejev atomski model ne predvideva natančne lokacije elektrona na orbiti, v kateri se premika.
V tem modelu se elektroni dojemajo kot valovi, ki se gibljejo okoli orbite brez specifične lokacije, kar uvaja pojem elektronske orbite..
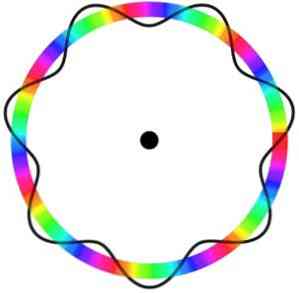
Poleg tega Brogliejev atomski model, analogen Schrödingerjevemu modelu, ne upošteva rotacije elektronov na svoji osi (zavrtite).
Z ignoriranjem notranjega momentnega momenta elektronov se prostorske spremembe teh subatomskih delcev zanemarijo..
V istem vrstnem redu idej ta model ne upošteva sprememb v obnašanju hitrih elektronov kot posledice relativističnih učinkov.
Zanimivi izdelki
Atomski model Schrödingerja.
Atomski model Chadwicka.
Atomski model Heisenberga.
Atomski model Perrina.
Atomski model Thomsona.
Atomski model Daltona.
Atomski model Diracovega Jordana.
Atomski model Demokrita.
Atomski model Bohra.
Reference
- Borova kvantna teorija in De Brogliejevi valovi (s.f.). Vzpostavljeno iz: ne.phys.kyushu-u.ac.j
- Louis de Broglie - Biografski (1929). © Nobelova fundacija. Vzpostavljeno iz: nobelprize.org
- Louis-Victor de Broglie (s.f.). Vzpostavljeno iz: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Vzpostavljeno iz: britannica.com
- Atomski model De Broglie. Nacionalna univerza za izobraževanje na daljavo. Španija Vzpostavljeno iz: ocw.innova.uned.es
- Valovi materije Louis De Broglie (s.f.). Vzpostavljeno iz: hiru.eus
- Von Pamel, O., in Marchisio, S. (s.f.). Kvantna mehanika Nacionalna univerza v Rosariju. Vzpostavljeno iz: fceia.unr.edu.ar


