Ziehl-Neelsenova podlaga, reagenti in tehnika
The Ziehl-Neelsen madež v barvni tehniki za identifikacijo mikroorganizmov, odpornih proti alkoholu in kislinam (AAR). Ime tega mikrobiološkega postopka se nanaša na njegove avtorje: bakteriolog Franz Ziehl in patolog Friedrich Neelsen..
Ta tehnika je vrsta diferencialne obarvanosti, ki pomeni uporabo različnih barvil, da bi ustvarili kontrast med strukturami, ki jih želite opazovati, razlikovati in kasneje identificirati. Ziehl-Neelsen madež se uporablja za identifikacijo nekaterih vrst mikroorganizmov.
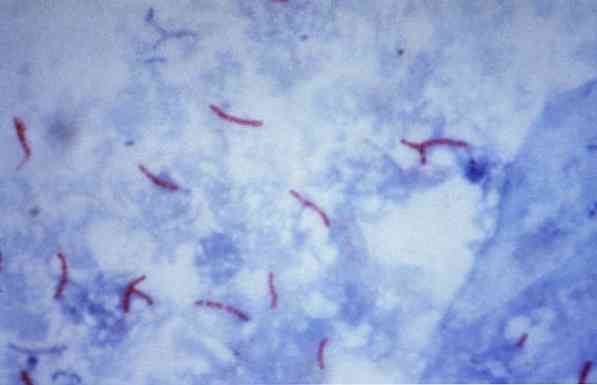
Nekateri od teh mikroorganizmov so mikobakterije (npr, Mycobacterium tuberculosis), nokardije (na primer, Nocardia sp.) in nekateri enocelični paraziti (na primer, Cryptosporidium parvum). Mnoge bakterije lahko razvrstimo po običajni tehniki, imenovani Gramova barva.
Vendar pa nekatere bakterijske skupine zahtevajo druge metode za njihovo identifikacijo. Tehnike, kot je Ziehl-Neelsenovo barvanje, zahtevajo kombinacije barvil s toploto, da se prva pritrdi na celično steno.
Nato pride do procesa razbarvanja, ki omogoča dva rezultata: odpornost ali občutljivost na razbarvanje kislin in alkoholov.
Indeks
- 1 Fundacija
- 1.1 Sekundarna barva
- 2 Reagenti
- 2.1 Primarna obarvanost
- 2.2 Raztopina za razbarvanje
- 2.3 Sekundarna barva (barvilo)
- 3 Tehnika
- 3.1 Postopek obarvanja pri hitrosti kisline
- 4 Reference
Fundacija
Osnova te tehnike barvanja temelji na lastnostih celične stene teh mikroorganizmov. Stena oblikuje vrsta maščobnih kislin, imenovanih mikolične kisline; Za njih so značilne zelo dolge verige.
Ko imajo maščobne kisline zelo dolge strukture, lahko lažje zadržijo barve. Nekatere rodove bakterij je zelo težko obarvati z barvanjem po Gramu, zaradi visoke vsebnosti mikolne kisline v celični steni..
V barvi Ziehl-Neelsen se uporablja fenolna spojina carbol fuchsin, osnovno barvilo. To je zmožnost interakcije z maščobnimi kislinami celične stene, ki je pri sobni temperaturi voščena tekstura.
Barvno obarvanje fuksina se izboljša v prisotnosti toplote, ker se vosek tali in molekule barv se hitreje premikajo v celično steno.
Kislina, ki se uporablja kasneje, služi za razbarvanje celic, ki niso bile obarvane, ker njihova stena ni bila dovolj povezana z barvilom; zato je moč razbarvanja kisline sposobna odstraniti kislinsko barvilo. Celice, ki se upirajo temu razbarvanju, se imenujejo odporne proti kislinam.
Sekundarna barva
Po razbarvanju vzorca je to v nasprotju z drugim barvilom, ki se imenuje sekundarno barvilo. Na splošno uporabljamo metilen modro ali malabitno zeleno.
Sekundarna barva obarva osnovni material in posledično ustvari kontrast strukturam, ki so bile barvane v prvem koraku. Samo razbarvane celice absorbirajo drugo barvo (anti-madež) in vzamejo barvo, medtem ko kislinsko odporne celice ohranijo rdečo barvo..
Ta postopek se pogosto uporablja za identifikacijo Mycobacterium tuberculosis in Mycobacterium leprae, ki se imenujejo kislinsko hitre bacile.
Reagenti
Primarno barvanje
Uporablja se karboksin 0,3% fuksin (filtriran). To barvilo se pripravi iz mešanice alkoholov: fenola v etanolu (90%) ali metanola (95%) in v tej zmesi se raztopi 3 g bazične fuksine..
Raztopina za razbarvanje
V tem koraku lahko uporabimo raztopine 3% alkoholne kisline ali 25% žveplove kisline.
Sekundarna barva (proti barvilu)
Barvilo, ki se najpogosteje uporablja za kontrast v vzorcih, je običajno 0,3% metilen modro. Lahko pa se uporabijo tudi drugi, kot je 0,5% malahitno zelena.
Tehnika
Postopek obarvanja pri hitrosti kisline
Pripravite bakterijski razmaz
Ta pripravek je narejen na suhem in suhem steklu, ki sledi varnostnim ukrepom za sterilnost.
Sušenje brisa
Pustite, da se razmaz posuši pri sobni temperaturi.
Vzorec segrejemo
Vzorec je treba segrevati z uporabo požara na spodnji diapozitiv. Fiksiranje z alkoholom se lahko izvede, kadar bris ni bil pripravljen z izpljunkom (obdelan z natrijevim hipokloritom, da bi ga pobelil) in če ga ne bo takoj obarvan..
M. tuberculosis Izloča se z belilom in med postopkom obarvanja. Termofiksiranje netretiranega izpljunka ne bo ubilo M. tuberculosis, ker je fiksacija z alkoholom baktericidna.
Pokrijte madež
Barva je prekrita z raztopino karbusa (primarna osnovna barva).
Segrejte madež
To naredimo 5 minut. Opaziti morate sproščanje pare (približno 60 ° C). Pomembno je, da se ne pregreje in da se vzorec ne seži.
Kar zadeva segrevanje madeža, je pri ogrevanju fuksin karbol treba paziti, zlasti če se barvanje izvaja na pladnju ali drugem vsebniku, v katerem so bile iz prejšnje madeže zbrane lahko vnetljive kemikalije..
Pod stekelce je treba nanesti le majhen plamen z osvetljenim brisom, ki je bil predhodno navlažen z nekaj kapljicami kislega alkohola, metanola ali 70% etanola. Izogibajte se uporabi velikega tampona, namočenega v etanol, ker je to nevarnost požara.
Umijte madež
To pranje je treba opraviti s čisto vodo. Če voda iz pipe ni čista, umazanijo izperite s filtrirano ali destilirano vodo, po možnosti.
Umazanijo prekrijte s kislim alkoholom
Ta kislinski alkohol mora biti 3%. Zajetje poteka 5 minut ali dokler madež ni dovolj obarvan, to je bledo rožnato.
Upoštevati je treba, da je kislinski alkohol vnetljiv; zato ga je treba uporabljati zelo previdno. Izogibajte se bližini virov vžiga.
Umijte madež
Pranje mora biti s čisto, destilirano vodo.
Pokrijte razmaz z barvilom
Lahko je zeleni malakit (0,5%) ali metilensko modro (0,3%) barvilo za 1 ali 2 minuti, z najdaljšim časom, če je bris tanek.
Umijte madež
Ponovno je treba uporabiti čisto vodo (destilirano).
Drain
Hrbtno stran drsnika je treba očistiti in madež namestiti na drenažno polico, da se posuši na zraku (ne uporabljajte vpojnega papirja za sušenje)..
Raztopino pregledajte v mikroskopu
Uporabiti je treba 100X objektiv in potopno olje. Sistematično preglejte razmaz in zapišite ustrezna opažanja.
Razložite rezultate
Teoretično se mikroorganizmi, ki so pobarvani z rdečkasto barvo, štejejo za kislinsko pozitivne (AAR +)..
Nasprotno, če so mikroorganizmi obarvani modro ali zeleno, se glede na barvilo, ki se uporablja kot proti-barvilo, štejejo za negativno kislinsko odporno kislino (AAR-)..
Reference
- Apurba, S. in Sandhya, B. (2016). Osnove praktične mikrobiologije (1. izd.). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobiologija z boleznimi po telesnem sistemu (4. izd.). Pearson Education, Inc..
- Heritage, J., Evans, E. in Killington, A. (1996). Uvodna mikrobiologija (1. izd.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. in Morton, V. (2006). Laboratorijski priročnik in delovni zvezek iz mikrobiologije: aplikacije za nego pacientov (11. izd.). McGraw-Hill izobraževanje.
- Vasanthakumari, R. (2007). Učbenik mikrobiologije (1. izd.). B.I. Publikacije PVT.


