Gram temeljna podlaga, materiali, tehnika in uporaba
The Barvilo po Gramu je najpreprostejša in najbolj uporabna tehnika barvanja v diagnostični mikrobiologiji. To tehniko je leta 1884 ustvaril danski zdravnik Hans Christian Gram, ki je bakterije uspel razvrstiti po Gramu pozitivno in po Gram negativno glede na sestavo celične stene..
Tehnika je Hucker leta 1921 doživel nekatere spremembe, da bi stabiliziral reagente in izboljšal kakovost madeža, tako da je barva po Gramu znana tudi kot Gram-Hucker.
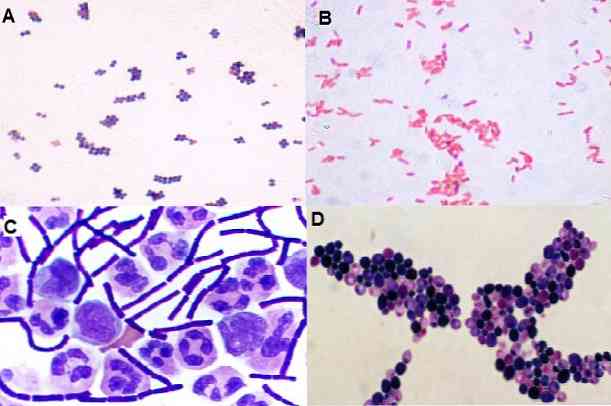
S to tehniko je mogoče opazovati tudi obliko, ki jo imajo mikroorganizmi, in sicer ali so koki, bacili, kokobacili, pleomorfni, filamentozni. Tako kot njegova porazdelitev v prostoru: v grozdu, v verigi, izolirani, v parih, v tetradah itd..
Pri sumu na bakterijsko okužbo je treba večino prejetih vzorcev razpršiti na stekelce in obarvati z gramom za pregled pod mikroskopom..
Poročilo o Gramu bo zdravnika vodilo o tem, katera vrsta mikroorganizma je lahko vzrok za okužbo, preden dobi končni rezultat pridelka..
V nekaterih primerih je življenje bolnika zelo ogroženo, zato zdravniki nujno potrebujejo Gramovo poročilo za empirično zdravljenje, medtem ko čakajo na identifikacijo mikroorganizma..
Na primer, če Gram razkrije, da v cerebrospinalni tekočini obstajajo Gram pozitivni koki, bo zdravnik usmeril začetno zdravljenje z antibiotiki, ki odpravljajo to vrsto bakterij, v skladu s protokoli, ki so bili zanj določeni..
Ko pride končni rezultat z imenom izoliranega mikroorganizma in ustreznim antibiogramom, bo zdravnik ocenil, ali naj zdravljenje spremeni ali ne. Ta odločitev bo sprejeta v skladu s študijo o dovzetnosti mikroorganizma za antibiotike, ki jih prejme, in evolucijo bolnika..
Indeks
- 1 Fundacija
- 2 Materiali
- 3 Priprava barvil in reagentov
- 3.1 Raztopina kristalno vijolične barve
- 3.2 Iodo-Lugol
- 3.3 Beljenje
- 3.4 Kontrast
- 4 Shranjevanje reagentov
- 5 Priprava širjenja vzorca za barvanje
- 5.1-gramov neposrednih vzorcev
- 5,2-gram rastlin
- 6 Tehnika
- 7 Utility
- 8 Pogoste napake
- 9 Reference
Fundacija
To je tehnika, ki predstavlja 4 temeljne korake: obarvanje, fiksiranje z jedkanjem, razbarvanje in kontrakticiranje. Zato jih ta tehnika poleg barvanja bakterij tudi razlikuje.
Kristalno vijolično je prvo uporabljeno barvilo. Ima afiniteto do peptidoglikana in vijolične barve, obarva vse prisotne bakterije, nato pa se postavi lugol, ki deluje kot lužilo, to pomeni, da bo povzročil nastanek netopnih kompleksov kristal violet-jod - ribonuklearne proteine v celici..
Gram-pozitivne bakterije, ki imajo debelo steno peptidoglikana, tvorijo več kompleksov (kristalno vijolično-jod), zato ohranijo barvilo.
Prav tako vpliva na to, da stena Gram-pozitivnih bakterij vsebuje večjo količino nenasičenih kislin, ki kažejo visoko afiniteto za oksidacijska sredstva (Lugol)..
Medtem pa imajo Gram-negativne bakterije tanek sloj peptidoglikana, zaradi česar so bakterije manj kompleksne kot po Gramu pozitivne bakterije..
Nato pride korak razbarvanja, kjer se Gram pozitivne in Gram negativne bakterije obnašajo drugače.
Gram negativne bakterije vsebujejo zunanjo membrano, bogato z lipopolisaharidi, ki je del njene celične stene. Maščobe uničimo ob stiku z alkoholom acetonom, tako da se zunanja membrana destabilizira, sprosti vijolični kristal.
Tako je potemnilo safranin ali osnovno fuksin, pri čemer je rdeča barva.
V primeru Gram-pozitivnih bakterij, se upirajo razbarvanju, ker belilo deluje tako, da zapira pore, kar preprečuje, da bi kristalni vijolični / jodni kompleks pobegnil.
Zato je obarvanost z vijoličastim kristalom stabilna in ni prostora za safranin ali fuksin. Zaradi tega te bakterije obarvajo intenzivno modro ali vijolično barvo.
Materiali
Gram barvni komplet je sestavljen iz:
- Vijolični kristali
- Lugol
- Acetonski alkohol
- Safranin ali osnovni fuksin
Priprava barvil in reagentov
Raztopina kristalno vijolične barve
Rešitev A:
Vijolični kristal -2 gr
Etilni alkohol 95% -20 cm
Rešitev B:
Amonijev oksalat -0,8 gr
Destilirana voda - 80 cm3
Za končno pripravo vijoličnega kristala je treba raztopino 1:10 razredčiti z destilirano vodo in zmešati s 4 deli raztopine B. Zmes pred uporabo shranimo 24 ur. Filtrira se v bučki za oranžno barvanje s papirnim filtrom.
Količino, ki bo dnevno uporabljena, se prenese v jantarno steklenico s kapalko.
Iodo-Lugol
Natehtamo in izmerimo navedeno količino vsake spojine, kot sledi:
Kristali joda - 1gr
Kalijev jodid - 2gr
Destilirana voda -300 cm3
Kalijev jodid se raztopi malo po malo v vodi in nato doda jod. Raztopino obrijemo na rumeno stekleničko.
Znesek, ki bo dnevno uporabljen, se prenese v manjšo rumeno steklenico s kapalko.
Beljenje
95% etilni alkohol -50 ml
Aceton - 50 ml
Pripravljen je v enakih delih. Dobro pokrijte, nagiba se, da izhlapi.
Postavite v steklenico s kapalko.
Ta pripravek zagotavlja razbarvanje v zmernem času 5-10 sekund in je najbolj priporočljivo.
Začetniki raje uporabljajo samo 95% etilni alkohol, kjer je razbarvanje počasnejše od 10 do 30 sekund.
Medtem ko najbolj izkušeni lahko uporabljajo čisti aceton, kjer se razbarvanje pojavi zelo hitro od 1 do 5 sekund.
Kontrast
Osnovna raztopina safranina
Safranina -2.5 gr
Etilni alkohol 95% -100 cm3
Po tehtanju se navedena količina safranina raztopi v 100 cm3 etilnega alkohola do 95%..
Delovno raztopino safranina pripravimo iz osnovne raztopine.
V ta namen izmerite 10 cm3 osnovne raztopine, dodajte 90 cm3 destilirane vode, da dokončate 100 ml.
Priporočljivo je, da količino, ki bo dnevno porabljena, prenesete v rumeno steklenico s kapalko.
Mikroorganizmi, ki so po Gram-Huckerjevi barvi šibki po Gramu negativni, kot so nekateri anaerobi \ t, Legionella sp, Campylobacter sp in Brucella sp, lahko so veliko bolje obarvani, če se uporablja modifikacija Kopeloffa za barvanje po Gram-Huckerju, imenovana Gram-Kopeloff madež, ki se uporablja.
Ta tehnika spremeni barvilo safranina z osnovno fuksin. S to modifikacijo je mogoče učinkovito barvati prej omenjene mikroorganizme.
Shranjevanje reagentov
Pripravljena barvila je treba shranjevati pri sobni temperaturi.
Priprava vzorca se razširi na barvo
Vzorec mora vsebovati vsaj 105 mikroorganizmov pred opazovanjem mikroorganizma v razmazu. Namazi so lahko narejeni iz neposrednega vzorca ali kultur v trdnih ali tekočih medijih.
Namazi morajo biti enakomerni, dobro porazdeljeni in ne predebeli za boljšo vizualizacijo prisotnih struktur.
-Gram neposrednih vzorcev
Urinski gram brez centrifuge
Mešanica urina in 10 μl na stekelcu. Opazovanje vsaj enega bakterijskega / Immersion polja kaže, da obstaja okužba.
To pomeni, da bo kultura imela približno več kot 100.000 CFU / ml (10%)5 CFU / mL) urina v 85% primerov.
Ta metoda ni uporabna za štetje kolonij pod 100.000 CFU.
LCR Gram
CSF je treba centrifugirati, supernatant odstraniti in pelet razširiti na stekelcu. Ta tekočina je v normalnih pogojih sterilna; opazovanje bakterij kaže na okužbo.
Gram vzorcev dihal
Čeprav je možno, da je spramum, bronhialno ali bronhoalveolarno izpiranje, čeprav obstaja vrsta mikroorganizmov, vedno v pomoč pri diagnozi, poleg tega, da je uporabna tudi vrsta opazovanih celic.
V primeru sputuma je treba razmaz pripraviti z najbolj gnojnim delom vzorca.
Stol Gram
Za to vrsto vzorcev ni priporočljivo izvajati Gram, ker nima diagnostične vrednosti.
-Gramske pridelke
Lahko se izvede na dva načina, eden iz tekočih pridelkov in drugi iz trdnih pridelkov.
Tekoči posevki
Iz tekočih kultur je zelo preprosta; pod vžigalnikom se vzame več pečenk iz mutne juhe in se položijo na čisto in suho drsno ploščo, ki krožno premika od središča proti obrobju, da se material enakomerno porazdeli..
Pusti se, da se spontano posuši v zraku. Ko se posuši, je material pritrjen na ploščo s toploto. Za to, s pomočjo objemke, list 3 poteka 4-krat skozi plamen Bunsenovega gorilnika, pri tem pa pazimo, da material ne sežge..
Ploščo pustimo, da se ohladi in jo postavimo na barvni mostiček.
Trdne poljščine
Za izvedbo podaljšanja za Gram madež iz trdne kulture nadaljujte na naslednji način:
Pred izbiro kolonij, ki jih je treba vzeti, je treba pripraviti diapozitiv, tako da se približno dve sterilni fiziološki raztopini da približno dve kapljici.
Če originalna kulturna plošča vsebuje več različnih vrst kolonij, bo za izvedbo po Gramu izbrana izolirana kolonija. Vsaka kolonija se vzame s platinsko zanko, da se raztopi v raztopini soli, ki je bila predhodno nameščena na stekelcu.
Krožni premiki so podani od središča do periferije, da se kolonija enakomerno porazdeli na drsniku..
Pusti se, da se spontano posuši v zraku. Ko se list posuši, ga fiksiramo s toploto, kot je razloženo zgoraj (plameni drsnik z vžigalnikom), pri čemer pazimo, da materiala ne sežge.
Ta postopek je treba opraviti pri vsaki vrsti kolonij. Na list papirja je treba navesti vrstni red opazovanega, na primer:
Kolonija 1: Rumena beta-hemolitična kolonija: Gram-pozitivni koki so bili opaženi v grozdih
Kolonija 2: kremna kolonija brez hemolize: Opažene so bile gramnegativne kokobacili.
Vsak list mora biti označen, da ve, kaj opazujemo.
Tehnika
Tehnika barvanja po Gramu je izjemno enostavna za izvajanje in relativno poceni in je ni mogoče zamuditi v mikrobiološkem laboratoriju.
Enako velja za naslednje: \ t
- Odstranite bris s toploto in položite na barvni most.
- List je 1 minuto popolnoma prekrit z vijoličnim steklom.
- Operite z vodo. Ne posušite
- Ploščo prekrijemo z Lugolovo raztopino, pustimo 1 minuto. Operite z vodo. Ne posušite.
- Mešajte 5-10 sekund z rahlim stresanjem v acetonskem alkoholu. Ali pa postavite ploščo v pokončen položaj in kapljice sredstva za razbarvanje na površini spustite, dokler se preostalo vijolično steklo ne odvleče. Ne prekoračite.
- Operite z vodo. Ne posušite.
- Zamenjajte pločevino na barvnem mostu in pokrijte 30 sekund z safraninom (Gram-Hucker) ali 1 min z osnovno fuksinom (Gram-Kopeloff).
- Operite z vodo
- Pustite, da se spontano posuši v navpičnem zraku.
Ko se posuši, postavite 1 kapljico potopnega olja, da ga opazujete pod objektivom 100X v optičnem mikroskopu.
Utility
Ta tehnika omogoča razlikovanje med morfotipeintialnimi razlikami večine bakterij.
Kvas se odlikuje tudi po tej barvi. Vzamejo kristalno vijolično, kar pomeni, da obarvajo Gram pozitivno.
Po drugi strani pa lahko ločimo Gram-pozitivne spore-formirajoče bacile, v katerih je opazen jasen prostor znotraj bacila, kjer je nastala endospora, čeprav se spore ne obarvajo dobro. Za uporabo spore se uporabljajo druge tehnike, kot je Shaeffer-Fulton.
Opozoriti je treba, da ta barva ne služi za barvanje vseh vrst bakterij, to je, da obstajajo primeri, ko barvanje ne deluje.
V tem primeru lahko omenimo bakterije, ki nimajo celične stene. Na primer: rod Mycoplasma, sferoplasti, Ureaplasma, L-oblike in protoplasti.
Prav tako močno obarva bakterije s stenami, bogatimi z mikoličnimi kislinami, kot so mikobakterije in znotrajcelične bakterije, kot so Chlamydias in Rickettsias..
Prav tako je neučinkovito obarvati večino spiroketalnih bakterij.
Obstajajo bakterije istega rodu, ki jih lahko opazimo v istem vzorcu kot Gram pozitivne in kot Gram negativne. Ko se to zgodi, se imenuje spremenljivo barvilo po Gramu, ki je lahko posledica spreminjanja hranil, temperature, pH ali koncentracije elektrolitov..
Pogoste napake
Beleži se preveč
Pretirjanje v koraku razbarvanja lahko povzroči opazovanje lažnih gram-negativnih mikroorganizmov.
Ne čakajte dovolj časa za sušenje, da dodate olje za potopitev:
Ta napaka povzroči nastanek maščobnih micel, ki otežujejo opazovanje prisotnih struktur. To se zgodi, ko se olje pridruži vodnim molekulam, ki so prisotne v razmazu.
Povrnitev vrstnega reda reagentov:
Napaka, kot je ta, bo povzročila, da bodo Gram-negativne bakterije prikazale vijolično, kar pomeni, da je lažno Gram-pozitivno.
Uporabite stare poljščine (trdne ali tekoče):
Lahko povzroči, da so Gram pozitivne bakterije obarvale Gram negativne (lažne negativne po Gramu). To se zgodi, ker je v starih kulturah verjetno, da obstajajo mrtve ali poslabšane bakterije in pod temi pogoji bakterije ne ohranijo vijoličnega kristala..
Uporabite zelo staro rešitev Lugol:
Sčasoma lugol izgubi svoje lastnosti in barva bledi. Če se uporablja že degeneriran reagent, kristal violet ne bo fiksiran, zato obstaja možnost pridobitve vizualizacije mikroorganizmov, ki so lažno gram negativni..
Modro ozadje
Pravilno obarvano ozadje bo rdeče barve. Modro ozadje kaže, da je bila sprememba barve nezadostna.
Reference
- Ryan KJ, Ray C. 2010. Sherris. Mikrobiologija Medical, 6. izdaja McGraw-Hill, New York, ZDA
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiološka diagnoza. (5. izd.). Argentina, uredništvo Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Mikrobiološka diagnoza Bailey & Scott. 12 ed. Argentina Panamericana S.A Uvodnik
- Casas-Rincón G. 1994. Splošna mikologija. 2. Ed Universidad Central de Venezuela, Knjižnične izdaje. Venezuela, Caracas.
- "Obarvanost po Gramu" Wikipedija, Prosta enciklopedija. 4. okt. 2018, 23:40 UTC. 9. december 2018, 17:11. Vzeto iz es.wikipedia.org.
- González M, González N. 2011. Priročnik za medicinsko mikrobiologijo. 2. izdaja, Venezuela: Direktorat za medije in publikacije Univerze Carabobo.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Osnovno barvanje v mikrobiološkem laboratoriju. Raziskave o invalidnosti. 2014; 3 (1): 10-18.


