Giemsa temelj za barvanje, materiali, tehnika in uporaba
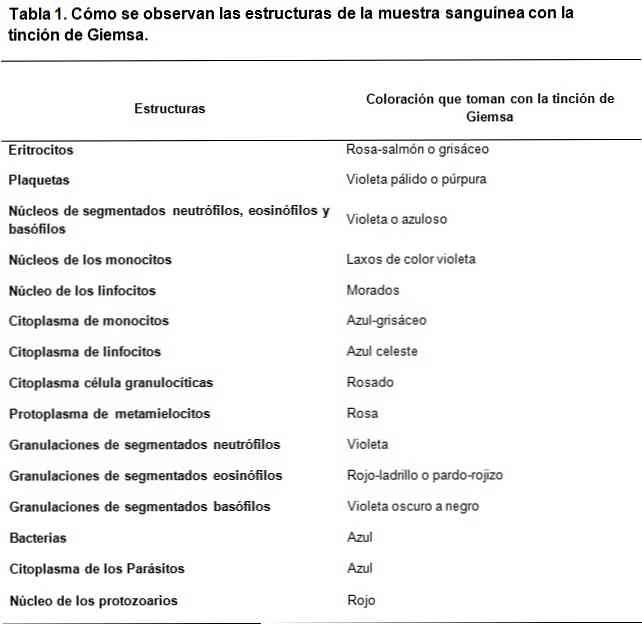
The Giemsa madež je vrsta obarvanja kliničnih vzorcev, ki temelji na mešanici kislinskih in osnovnih barvil. Njegovo ustvarjanje je navdihnilo delo Romanowskega, kjer ga je Gustav Giemsa, kemik in bakteriolog iz Nemčije, izpopolnil z dodajanjem glicerola za stabilizacijo spojin..
Spremembe, ki so nastale v originalni tehniki Romanowskega, so omogočile bistveno izboljšanje mikroskopskih opazovanj, zato se je tehnika krstila z imenom Giemsa.
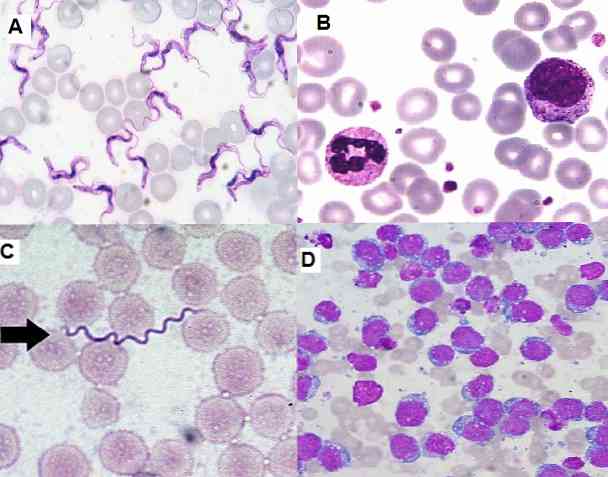
Ker gre za preprosto tehniko, ki je zelo funkcionalna in ekonomična, se trenutno pogosto uporablja v kliničnem laboratoriju za hematološke brise, vzorce kostnega mozga in tkivne dele..
Giemsa tehnika barvanja je zelo uporabna za citološke študije, saj omogoča opazovanje specifičnih struktur celic. Ta tehnika obarva citoplazme, jedra, nukleole, vakuole in granule celic, tako da lahko razlikujejo tudi fine sledove kromatina.
Poleg tega je mogoče zaznati pomembne spremembe v velikosti, obliki ali obarvanosti jedra, kjer je mogoče vizualizirati izgubo odnosa jedro-citoplazma..
Po drugi strani pa omogoča identifikacijo nezrelih celic v kostnem mozgu in periferni krvi, kar je pomembno za diagnozo resnih bolezni, kot je levkemija. Prav tako je mogoče med drugim odkriti hemoparazite, ekstra in intracelularne bakterije, glivice.
V citogenetiki se zelo uporablja, saj je možno preučiti mitozo celic.
Indeks
- 1 Temelj barve Giemsa
- 2 Materiali
- 2.1 Materiali za pripravo matične raztopine
- 2.2 Način priprave matične raztopine
- 2.3 Materiali za pripravo puferske raztopine
- 2.4 Končna priprava barvila
- 2.5 Dodatni materiali, potrebni za barvanje
- 3 Tehnika
- 3.1 Postopek barvanja
- 4 Pripomočki
- 4.1 Hematologija
- 4.2 Mikologija
- 4.3 Bakteriologija
- 4.4 Parazitologija
- 4.5 Citologija
- 4.6 Citogenetika
- 5 Raziskave, ki dokazujejo učinkovitost Giemsa barvanja
- 6 Priporočila za dobro barvanje
- 7 Pogoste napake pri barvanju Giemse
- 7.1 Izjemno modra barva
- 7.2 Preveč roza obarvanost
- 7.3 Prisotnost oborin v razmazu
- 7.4 Prisotnost morfoloških artefaktov
- 8 Način shranjevanja
- 9 Reference
Osnova barve Giemsa
Barvila tipa Romanowsky temeljijo na uporabi kontrasta med kislinskimi in osnovnimi barvili, da se doseže obarvanje osnovnih in kislih struktur. Kot je razvidno, obstaja afiniteta kislih barvil za barvanje osnovnih struktur in obratno.
Uporablja se osnovno barvilo metilen modro in njegovi oksidirani derivati (Azure A in Azure B), medtem ko je kislinsko barvilo eozin..
Kislinske strukture celic so nukleinske kisline, med drugim tudi granule segmentiranih bazofilcev, zato bodo barvane z metilensko modro barvo..
V tem istem smislu so osnovne strukture celic hemoglobin in nekatere granule, kot so tiste, ki jih vsebujejo segmentirani eozinofili, med drugim; ti bodo obarvani z eozinom.
Po drugi strani pa zaradi tega, ker sta metilen modra in azurna barva značilna metakromatična barvila, lahko različnim strukturam zagotovita različen ton glede na obremenitev polianij, ki jih imajo..
Tako lahko strateška kombinacija bazičnih in kislih barvil razvije širok spekter barv, glede na biokemične značilnosti vsake strukture, hoje skozi bledo modro, temno modro, lila in vijolične tone v primeru kislih struktur..
Medtem ko je obarvanost, ki jo zagotavlja eozin, bolj stabilna, ustvarja barve med rdečkasto-oranžno in lososovo.
Materiali
Materiali za pripravo matične raztopine
Priprava osnovne raztopine zahteva tehtanje 600 mg praška Giemsa, merjenje 500 cm3 metilnega alkohola brez acetona in 50 cm3 nevtralnega glicerina..
Način priprave matične raztopine
Težki prašek Giemsa položite v malto. Če so grudice, jih je treba razpršiti. Nato dodamo precejšnjo količino izmerjenega glicerina in dobro premešamo. Dobljeno zmes vlijemo v čisto čisto rumeno stekleničko.
Preostali del glicerina dajemo v malto. Ponovno zmešamo, da očistimo preostalo barvo, ki je bila pritrjena na stene malte, in jo vlijemo v isto steklenico.
Steklenico pokrijemo in jo 2 uri prenesemo v vodno kopel pri 55 ° C. Medtem ko je v kopeli z vodno mejo, mešanico rahlo premešajte vsakih pol ure.
Nato pustimo, da se zmes ohladi, da se da alkohol. Prej se del izmerjenega alkohola da v malto, da se konča izpiranje tistega, kar je ostalo od barvila, nato pa se doda v mešanico skupaj s preostalim alkoholom..
Ta pripravek naj dozori vsaj 2 tedna. Del, ki se uporablja za materinsko raztopino, je treba filtrirati.
Da bi se izognili kontaminaciji pripravka, je priporočljivo, da se del, ki bo v stalni uporabi, prenese na majhno jantarno steklenico s kapalko. Napolnite vsakič, ko zmanjka reagenta.
Materiali za pripravo raztopine pufra
Po drugi strani pa pripravimo pufersko raztopino pri pH 7,2, kot sledi:
Stehtamo 6,77 g natrijevega fosfata (brezvodnega) (NaHPO4), 2,59 g kalijevega dihidrogenfosfata (KH)2PO4) in destilirana voda do 1000 cm3.
Končna priprava barvila
Za pripravo končne raztopine za barvanje se izmeri 2 cm3 filtrirane osnovne raztopine in zmeša s 6 cm3 pufrske raztopine. Zmes mešamo.
Pomembno dejstvo, ki ga je treba upoštevati, je, da se tehnike priprave barve lahko spremenijo glede na komercialno hišo.
Dodatni materiali, potrebni za barvanje
Razen opisanih materialov mora biti opremljen z barvnimi mostovi, vodnimi zasloni ali odbojniki za pranje, listi za predmete ali pokrovi, štoparico za kontrolo časov obarvanja in uparjalnim papirjem ali drugim materialom, ki se lahko uporablja za sušenje gaza ali bombaž).
Tehnika
Postopek barvanja
1) Pred barvanjem morate vzorec razširiti na čisto steklo..
Vzorci so lahko kri, kostni mozeg, kosi histološkega tkiva ali cerviko-vaginalni vzorci. Priporočljivo je, da so zunanji delci tanki in imajo 1 ali 2 uri sušenja, preden jih obarvate.
2) Vse liste, ki jih morate obarvati, so na barvnem mostu. Vedno delajte v istem vrstnem redu in dobro označite vsak list.
3) Na razmaz postavimo nekaj kapljic 100% metilnega alkohola (metanola) in pustimo 3 do 5 minut, da se vzorec fiksira in dehidrira..
4) Metanol, ki je prisoten v listu, zavrzite in pustite, da se posuši na zraku.
5) Ko se posuši, raztopino za končno barvanje postavimo s kapalko, dokler ne pokrijemo celotnega lista. Pustite delovati 15 minut. Nekateri avtorji priporočajo do 25 min. Odvisno od poslovne hiše.
6) Barvilo izpraznite in razmaz operemo z destilirano vodo ali s 7,2 pufno raztopino.
7) Na pivnem papirju pustite, da se listi posušijo na prostem, razporejeni navpično s pomočjo opore.
8) Obrišite hrbtni del drsnika z gazo ali bombažno krpo, navlaženo z alkoholom, da odstranite preostalo barvo.
Pripomočki
Giemsa tehnika barvanja se uporablja na več področjih, vključno s hematologijo, mikologijo, bakteriologijo, parazitologijo, citologijo in citogenetiko..
Hematologija
To je najpogostejša pripomoček, ki se daje temu barvanju. Z njim lahko identificiramo vsako od celic, prisotnih v vzorcih kostnega mozga ali periferne krvi. Poleg ocene števila vsake serije lahko odkrijete levkocitozo ali levkopenijo, trombocitopenijo itd..
Ker je občutljiv za prepoznavanje nezrelih celic, je pomemben za diagnozo akutnih ali kroničnih levkemij. Prav tako je možno diagnosticirati anemijo, kot je npr..
Mikologija
Na tem področju se običajno uporablja za iskanje Histoplasma capsulatum (znotrajcelični dimorfni glivici) v vzorcih tkiva.
Bakteriologija
Pri hematoloških brisih, obarvanih z Giemsom, je mogoče zaznati Borrelias sp pri bolnikih, ki imajo bolezen, imenovano recurrentis vročine. Spirohete so med eritrociti bogati, v vzorcih, odvzetih na febrilnem vrhu.
Prav tako je možno vizualizirati znotrajcelične bakterije kot Rickettsias sp in Chlamydia trachomatis v okuženih celicah.
Parazitologija
Na področju parazitologije je Giemsa barvanje omogočilo diagnozo parazitskih bolezni, kot so malarija, Chagasova bolezen in leishmanioza..
V prvih dveh paraziti Plasmodium sp in Trypanosoma cruzi lahko jih vidimo v periferni krvi okuženih bolnikov, lahko jih najdemo v različnih fazah glede na fazo, v kateri je bolezen.
Za izboljšanje iskanja krvnih zajedavcev je priporočljivo uporabiti Giemsa madež, mešan z barvilom May-Grünwald..
Prav tako se lahko pri ocenjevanju vzorcev kožnih biopsij, obarvanih z Giemsom, kjer je najden parazit, diagnosticira kožni leišmanioza..
Citologija
Za citološko preučevanje endocervikalnih vzorcev se uporablja tudi Giemsa barvanje, čeprav to ni najpogosteje uporabljena tehnika za ta namen..
Toda v primerih pomanjkanja virov je mogoče uporabiti funkcionalnost, podobno tisti, ki jo ponuja tehnika Papanicolaou in po nižji ceni. Vendar pa zahteva strokovno znanje s strani izpraševalca.
Citogenetika
Pomembna značilnost Giemsa barve je njena sposobnost, da se močno veže na regije, bogate z DNK adenini in timini. To omogoča, da se DNK vizualizira med mitozo celic, v različnih stanjih kondenzacije.
Te študije so potrebne za odkrivanje kromatskih aberacij, kot so podvajanje, delecije ali translokacije različnih regij kromosomov..
Raziskave, ki dokazujejo učinkovitost Giemsa barvanja
Cannova in sodelavci (2016) primerjajo 3 barvne tehnike za diagnozo kožne leišmanioze.
Za to so uporabili vzorce, pridobljene iz poskusne živali (Mesocrisetus auratus) eksperimentalno inokuliranega z Leishmanias.
Avtorji so pokazali, da je bilo Giemsa barvanje boljše kot Pap-mart® in Gaffneyjevo barvanje. Zato so menili, da je madež Giemsa idealen za diagnosticiranje kožne leišmanioze.
Odlični rezultati, ki so jih dobili avtorji, so posledica dejstva, da kombinacija barvil, ki sestavljajo mešanico Giemsa, predstavljajo potrebne pogoje za ustvarjanje ugodnega kontrasta, ki omogoča jasno razlikovanje amastigotnih struktur, tako znotraj kot zunajcelične..
Tudi druge tehnike (Pap-mart® in Gaffney) so to storile, vendar na šibkejši način in zato težje vizualizirati. Zato je Giemsa barva priporočljiva za parazitološko diagnozo leishmanioze.
Podobno je študija Ramíreza in drugih (1994) ocenila veljavnost madežev Giemsa in Lendrum v konjunktivalnih brisih za identifikacijo Chlamydia trachomatis.
Avtorji so ugotovili, da imata Giemsa in Ledrum barvanje enako specifičnost, vendar je bila Giemsa bolj občutljiva.
To pojasnjuje, zakaj je trenutno Giemsa barvanje najpogosteje uporabljeno za diagnosticiranje klamidijskih okužb, še posebej, če je malo sredstev..
Priporočila za dobro barvanje
Sušenje listov se ne sme pospešiti. Čas previdnosti je treba čakati na sušenje na prostem. Približno 2 uri.
Za najboljše rezultate barve takoj po 2 urah.
Da bi se madeži, ki jih je treba pritrditi in bolje obarvali, vzorec porazdeliti na list, tako da ostane tanek in enakomeren sloj..
Prednostni vzorec krvi je kapilara, ker se razmaz izvede neposredno iz kapljice krvi, zato vzorec nima dodatka, kar daje prednost vzdrževanju celičnih struktur..
Če pa uporabljate vensko kri, morate zdravilo EDTA uporabiti kot antikoagulant in ne kot heparin, saj slednji ponavadi deformira celice..
Pogoste napake pri barvanju Giemse
V praksi tega barvanja lahko naredimo napake. O njih pričajo nenadne spremembe v odtenkih struktur.
Izjemno modra barva
Lahko je posledica:
- Zelo debele madeže
- Prekoračitev časa barvanja
- Premalo pranje.
- Uporaba reagentov, ki so precej nad nevtralnim pH (alkalni).
V teh pogojih so barve naslednjih struktur izkrivljene, tako da bodo eritrociti namesto umrlega rožnatega lososa videti zeleni, granule eozinofilcev, ki jih je treba pobarvati rdeče opeke, postanejo modre ali sive in tako naprej. odstopanja v običajnih tonalitetah.
Preveč roza obarvanost
Lahko je posledica:
- Pomanjkljivo barvanje.
- Podaljšano ali pretirano pranje.
- Slabo sušenje.
- Uporaba zelo kislih reagentov.
V tem posebnem primeru strukture, ki so običajno obarvane modre, ne bodo skoraj vidne, medtem ko bodo strukture, ki so obarvane rožnate, zelo pretirane tonalitete.
Primer: eritrociti bodo imeli svetlo rdečo ali močno oranžno barvo, jedrski kromatin bo videti bledo rožnato, granule eozinofilcev pa bodo postale svetlo rdeče..
Prisotnost oborin v razmazu
Vzroki so lahko:
- Uporabite umazane ali slabo oprane liste.
- Pazite, da se razmaz dobro ne posuši.
- Pustite fiksirno raztopino predolgo.
- Neustrezno pranje ob koncu obarvanja.
- Neustrezna filtracija ali nefiltracija uporabljenega barvila.
Prisotnost morfoloških artefaktov
V razmazih se lahko pojavijo morfološki artefakti, zaradi katerih je težko vizualizirati in interpretirati prisotne strukture. To je posledica:
- Vrsta uporabljenega antikoagulanta, kot je heparin.
- Uporaba umazanih, poškodovanih ali mastnih listov.
Način shranjevanja
Po pripravi je treba barvo hraniti pri sobni temperaturi (15 - 25 ° C), da se barva ne obori. Shraniti ga je treba v zaprti oranžni posodi.
Reference
- Cannova D, Brito E in Simons M. Ocenjevanje barvnih tehnik za diagnozo kožne Leishmaniasis. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Reagenti. Giemsa madež. Različica 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Španija.
- Clark G. Postopek barvanja (1981), 4 thhed. Williams & Willkins.
- Applied Clinical Chemistry Giemsa barva za diagnozo in vitro. Distributer: cromakit.es
- Ramírez I, Mejía M, Garcia de la Riva J, Hermes F in Grazioso C. Veljavnost madežev Giemsa in Lendrum v konjunktivalnih brisih za identifikacijo Chlamydia trachomatis. Bol Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Splošna mikologija. 1994. 2. Ed Universidad Central de Venezuela, Knjižnične izdaje. Venezuela, Caracas.
- "Giemsa madež." Wikipedija, Prosta enciklopedija. 1. sep 2017, 01:02 UTC. 6. december 2018, en.wikipedia.org.


