Struktura, lastnosti, nomenklatura in uporaba srebrovega oksida (Ag2O)
The srebrov oksid je anorganska spojina, katere kemijska formula je Ag2O. Sila, ki združuje njene atome, je popolnoma ionske narave; zato je sestavljen iz ionske trdne snovi, kjer je razmerje dveh Ag kationov+ interakcijo elektrostatično z anionom O2-.
Oksidni anion, O2-, izhaja iz interakcije srebrnih atomov površine s kisikom okolja; na podoben način kot železo in številne druge kovine. Srebrni kos ali nakit namesto rdečkanja in razpada v rje, postane črna, značilna za srebrov oksid.

Na primer, na zgornji sliki lahko vidite rjaven srebrni pokrovček. Zabeleži njeno črnino, čeprav še vedno ohranja okrasni lesk; zato se lahko celo zarjaveli srebrni predmeti štejejo za privlačne za dekorativne namene.
Lastnosti srebrovega oksida so takšne, da na prvi pogled ne pokvarijo prvotne kovinske površine. Ob sobni temperaturi se tvori s preprostim stikom s kisikom v zraku; in še bolj zanimivo, lahko razpade pri visokih temperaturah (nad 200 ° C).
To pomeni, da bi, če bi držali steklo slike in toploto intenzivnega plamena, povrnili svoj srebrni sijaj. Zato je njegova tvorba termodinamično reverzibilen proces.
Srebrov oksid ima tudi druge lastnosti in poleg preproste Ag-formule2Ali pa zajema kompleksne strukturne organizacije in bogato raznolikost trdnih snovi. Vendar pa Ag2Ali pa morda, poleg Ag2O3, najbolj reprezentativnih srebrovih oksidov.
Indeks
- 1 Struktura srebrovega oksida
- 1.1 Spremembe glede na število valenc
- 2 Fizikalne in kemijske lastnosti
- 2.1 Molekularna teža
- 2.2 Videz
- 2.3 Gostota
- 2.4 Tališče
- 2,5 Kps
- 2.6 Topnost
- 2.7 Kovalentni značaj
- 2.8 Razgradnja
- 3 Nomenklatura
- 3.1 Valencias I in III
- 3.2 Sistematična nomenklatura za kompleksne srebrove okside
- 4 Uporabe
- 5 Reference
Struktura srebrovega oksida
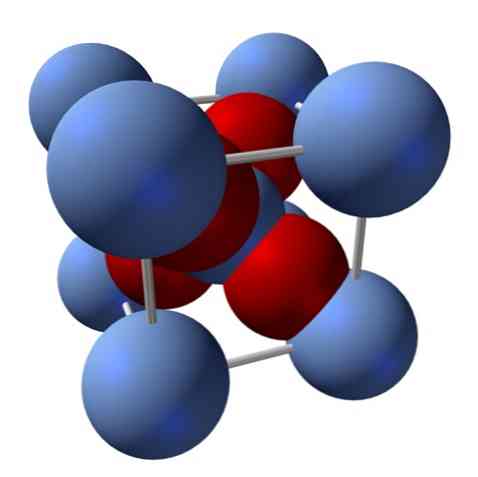
Kako je njegova struktura? Kot je bilo omenjeno na začetku: je ionska trdna snov. Zato v njeni strukturi ne more biti kovalentnih vezi Ag - O in Ag = O; ker bi se, če bi obstajalo, lastnosti tega oksida drastično spremenile. To je potem Ag ioni+ in O2- v razmerju 2: 1 in doživlja elektrostatično privlačnost.
Struktura srebrovega oksida je določena kot posledica načina, na katerega ionske sile odlagajo v prostoru Ag ione+ in O2-.
Na zgornji sliki, na primer, imate celično celico za kubični kristalni sistem: Agacije+ so srebrno modre krogle in O2- rdečkaste krogle.
Če preštejemo število krogel, boste ugotovili, da je na prvi pogled devet srebrno modrih in štiri rdeče barve. Upoštevani pa so le fragmenti kroglic, ki so vsebovani v kocki; pri štetju teh, ki so deli skupnih krogel, je treba izpolniti razmerje 2: 1 za Ag2O.
Ponovitev strukturne enote tetraedra AgO4 obkrožen s štirimi drugimi Ag+, zgrajena je vsa črna trdna snov (odstranitev vrzeli ali nepravilnosti, ki jih lahko imajo ti kristalni dogovori).
Spremembe glede na število valenc
Sedaj se ne osredotočamo na tetraeder AgO4 toda v vrstici AgOAg (opazujte tocke zgornje kocke) bo srebrov oksid iz druge perspektive sestavljen iz vec ionskih plasti, ki so razporejene linearno (ceprav nagnjene). Vse to je posledica "molekularne" geometrije okoli Ag+.
Zgoraj navedeno potrjujejo številne študije njene ionske strukture.
Srebro deluje pretežno z valenco +1, ker pri izgubi elektrona nastane elektronska konfiguracija [Kr] 4d10, ki je zelo stabilna. Druge valence, kot je Ag2+ in Ag3+ manj stabilne so, ker izgubijo elektrone iz orbitalov skoraj popolnoma napolnjene.
Agon3+, vendar je v primerjavi z Ag2+. Pravzaprav lahko sobivajo v družbi Ag+ Kemično bogatenje strukture.
Njegova elektronska konfiguracija je [Kr] 4d8, z neparnimi elektroni tako, da ji daje določeno stabilnost.
Za razliko od linearnih geometrij okrog Ag ionov+, Ugotovljeno je bilo, da so Agi3+ Je ravno kvadratno. Zato je srebrov oksid z ioni Ag3+ sestavljale plasti, sestavljene iz AgO kvadratov4 (ne tetraedre), ki so elektrostatično povezane z AgOAg linijami; Tak je primer Ag4O4 Ag2O. Ag2O3 z monoklinsko strukturo.
Fizikalne in kemijske lastnosti

Če opraskate površino srebrne skodelice glavne slike, dobite trdno, ki ni samo črna, temveč ima tudi rjave ali rjave tone (zgornja slika). Nekatere fizikalne in kemijske lastnosti, ki jih navajajo trenutki, so naslednje:
Molekularna teža
231,735 g / mol
Videz
Trdna črna rjava v obliki prahu (upoštevajte, da kljub temu, da je ionska trdna snov, nima kristaliničnega videza). Je brez vonja in zmešana z vodo daje kovinski okus
Gostota
7,14 g / ml.
Tališče
277-300 ° C. Seveda se topi v trdno srebro; to pomeni, da se verjetno razgradi pred oblikovanjem tekočega oksida.
Kps
1,52. 10-8 v vodi pri 20 ° C. Zato je spojina, ki je komaj topna v vodi.
Topnost
Če pozorno pogledate podobo njegove strukture, boste ugotovili, da so področja Ag2+ in O2- Ne strinjajo se skoraj v velikosti. Posledica tega je, da lahko samo majhne molekule prodrejo v notranjost kristalne mreže, zaradi česar je netopna v skoraj vseh topilih; razen tistih, kjer reagira, kot so baze in kisline.
Kovalentni znak
Čeprav je bilo večkrat rečeno, da je srebrov oksid ionska spojina, nekatere lastnosti, kot je njena nizka tališče, nasprotujejo tej trditvi..
Seveda, upoštevanje kovalentnega značaja ne razčlenjuje, kar je razloženo za njegovo strukturo, dovolj bi bilo, da bi ga dodali v strukturo Ag \ t2Ali model kroglic in palic za označevanje kovalentnih vezi.
Tudi tetraedre in kvadratne ravnine AgO4, in linije AgOAg bi bile povezane s kovalentnimi (ali kovalentnimi ionskimi) vezmi.
S tem v mislih, Ag2Ali pa bi bil dejansko polimer. Priporočljivo pa je, da jo obravnavamo kot ionsko trdno snov s kovalentnim značajem (čigar narava povezave je še danes izziv).
Razgradnja
Sprva je bilo omenjeno, da je njegova tvorba termodinamično reverzibilna, zato absorbira toploto, da se vrne v svoje kovinsko stanje. Vse to lahko izrazimo z dvema kemijskima enačbama za takšne reakcije:
4Ag (-e) + O2(g) => 2Ag2O (s) + Q
2Ag2O (s) + Q => 4Ag (s) + O2(g)
Kjer Q predstavlja toploto v enačbi. To pojasnjuje, zakaj požar, ki goreče na površini zarjavele srebrne skodelice, povrne njegov srebrn sijaj.
Zato je težko domnevati, da obstaja Ag2O (l), ker bi se takoj razgradilo s toploto; razen če je tlak previsok, da dobimo rjavo črno tekočino.
Nomenklatura
Ko je bila uvedena možnost Ag ionov2+ in Ag3+ poleg skupnega in prevladujočega Ag+, izraz „srebrov oksid“ se zdi nezadosten za sklicevanje na Ag2O.
To je zato, ker Ag+ je bolj bogat kot drugi, tako da je Ag vzet2Ali kot edini oksid; ki sploh ni pravilna.
Če upoštevate Ag2+ kot praktično neobstoječa zaradi njene nestabilnosti, potem bodo prisotni le ioni z valencami +1 in +3; to je Ag (I) in Ag (III).
Valencias I in III
Ker je Ag (I) najmanj valenca, se imenuje z dodajanjem pripone -oso k svojemu imenu argentum. Torej, Ag2Ali je: argentoso oksid ali, v skladu s sistematično nomenklaturo, diplomski monoksid.
Če se Ag (III) popolnoma ne upošteva, mora biti njegova tradicionalna nomenklatura: srebrov oksid namesto argentinskega oksida.
Po drugi strani pa se Ag (III), ki je večja valenca, doda pripono -ico v njeno ime. Torej, Ag2O3 je: srebrov oksid (2 Ag ioni)3+ s tremi O2-). Prav tako bi bilo njegovo ime po sistematični nomenklaturi: diploma trioksid.
Če opazimo strukturo Ag2O3, predpostavlja se lahko, da je to produkt oksidacije z ozonom, OR3, namesto kisika. Zato mora biti njegov kovalentni značaj večji, ker je kovalentna spojina z vezmi Ag-O-O-Ag ali Ag-O.3-Ag.
Sistematična nomenklatura za kompleksne srebrove okside
AgO, napisana tudi kot Ag4O4 Ag2O. Ag2O3, je srebrov oksid (I, III), ker ima tako valenco +1 kot +3. Njegovo ime po sistematični nomenklaturi bi bilo: tetraplate tetraoksid.
Ta nomenklatura je v veliko pomoč pri drugih stehiometrično bolj kompleksnih srebrovih oksidih. Recimo, na primer, dve trdni snovi 2Ag2O. Ag2O3 in Ag2O A 3Ag2O3.
Pisanje prvega na ustreznejši način bi bilo: Ag6O5 (štetje in dodajanje atomov Ag in O). Njegovo ime bi bilo potem heksaplat pentoksid. Upoštevajte, da ima ta oksid srebrno sestavo manj bogato kot Ag2O (6: 5) < 2:1).
Medtem ko drugače pišemo drugo trdno, bi bilo: Ag8O10. Njegovo ime bi bilo oktaplat decaoxide (z razmerjem 8:10 ali 4: 5). Ta hipotetični srebrov oksid bi bil "zelo oksidiran"..
Uporabe
Danes se še vedno izvajajo študije, ki iščejo nove in prefinjene uporabe srebrovega oksida. Nekatere njegove uporabe so navedene spodaj:
-Raztopi se v amoniaku, amonijevem nitratu in vodi, da nastane reagent Tollens. Ta reagent je uporabno orodje pri kvalitativnih analizah v laboratorijih za organsko kemijo. Omogoča določitev prisotnosti aldehidov v vzorcu, pri čemer je pozitiven odziv tvorba "srebrnega ogledala" v epruveti.
-Skupaj s kovinskim cinkom tvori primarne baterije srebrovega cinkovega oksida. To je morda ena izmed najpogostejših in najbolj domačih uporab.
-Uporablja se kot čistilec plina, ki absorbira na primer CO2. Ko se segreje, sprosti ujete pline in jih je mogoče večkrat ponovno uporabiti.
-Zaradi antimikrobnih lastnosti srebra je njegov oksid uporaben v študijah bioanalize in čiščenja tal.
-Je blago oksidacijsko sredstvo, ki lahko oksidira aldehide v karboksilne kisline. Uporablja se tudi v Hofmannovi reakciji (terciarni amini) in sodeluje v drugih organskih reakcijah, bodisi kot reagent ali katalizator..
Reference
- Bergstresser M. (2018). Srebrov oksid: formula, razgradnja in tvorba. Študija. Vzpostavljeno iz: study.com
- Avtorji in uredniki zvezkov III / 17E-17F-41C. (s.f.). Srebrni oksidi (Ag (x) O (y)) kristalna struktura, parametri mreže. (Numerični podatki in funkcionalni odnosi v znanosti in tehnologiji), vol. 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Potencialni vpliv bioenergetske obdelave na fizikalne in toplotne lastnosti prahu srebrovega oksida. International Journal of Biomedical Science and Engineering. 3, št. 5, str. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Razgradnja srebrovega oksida. Univerza v Oregonu Vzpostavljeno iz: chemdemos.uoregon.edu
- Flint, Deyanda. (24. april 2014). Uporaba baterij iz srebrovega oksida. Sciencing. Vzpostavljeno iz: sciencing.com
- Salman Montasir E. (2016). Študija nekaterih optičnih lastnosti srebrovega oksida (Ag2o) z UVVisibilnim spektrofotometrom. [PDF] Vzpostavljeno iz: iosrjournals.org
- Bard Allen J. (1985). Standardni potenciali v vodni raztopini. Marcel Dekker. Vzpostavljeno iz: books.google.co.ve


