Kemijska struktura, lastnosti in uporaba manganovega oksida (MnO2)
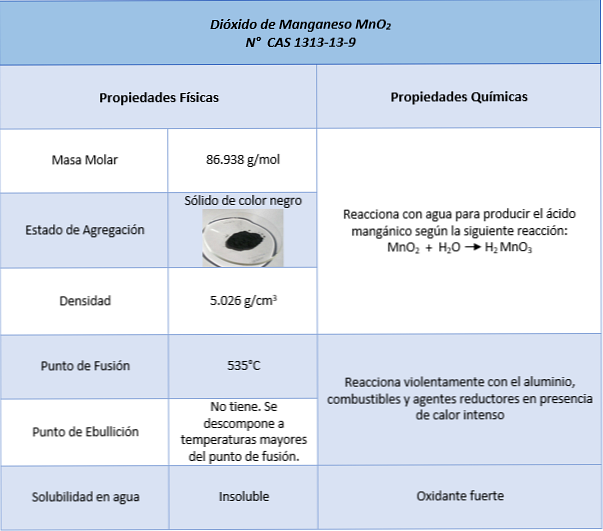
The manganov oksid (MnO2) je anorganska kemična spojina, ki jo tvori element mangan z oksidacijskim številom +4 in kisikom, ki ima pri tvorbi oksidov oksidacijsko število -2. Znana je tudi po imenih manganovega (IV) oksida in manganovega anhidrida.
To je trdna od temne do črne kave. Je v naravi kot mineralni pirolusit, črni in kristalizirani dendriti (razvejani raztezki). Lahko dobimo kot črni ostanek v reakciji med etilenom in kalijevim permanganatom po tvorbi glikola z oksidacijskim učinkom kalijevega permanganata..

V steklarski industriji je zelo pomemben zaradi svoje narave oksidacijskega sredstva, saj odpravlja zeleno barvo, ki izhaja iz železovih spojin in jih pretvarja v železne..
Indeks
- 1 Kemijska struktura
- 2 Lastnosti
- 3 Uporabe
- 3.1 Kot katalizator
- 4 Vplivi na zdravje
- 5 Reference
Kemijska struktura
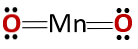
Kemična struktura spojine ustreza kemični strukturi anhidrida in ne osnovni oksidu, kot bi bilo pričakovano, ker je sestavljena iz kovine in nekovinskega materiala..
Ta poseben primer je posledica obnašanja, ki ga mangan vzame v različnih oksidacijskih stanjih, ki jih ima. Tako za oksidacijska stanja +2 in +3 nastanejo oksidi MnO in Mn2O3 da v reakciji z vodo tvorijo manganov hidroksid oziroma manganov hidroksid.
Vendar pa je Mn2O3 v rahlo kislem mediju se obnaša kot anhidrid. Pri oksidacijskih stanjih +4, +6 in +7, MnO2, MnO3 in MnO4 pri reagiranju z vodo tvorijo kisline.
V rahlo kislem mediju je MnO2 obnaša se kot osnovni oksid, tako da lahko tvori ustrezen hidroksid.

Upoštevati je treba, da v tem primeru ne omenjamo amfoternih lastnosti, po katerih se lahko spojina obnaša kot kislina ali kot baza. To je poseben primer vedenja Mn.
Lastnosti
Uporabe
- Uporablja se kot vir mangana
- Kot oksidant v alkalnih baterijah
- Barve za steklo, keramiko in porcelan.
- Pri pridobivanju klora in joda.
- Pri razgradnji vodikovega peroksida za tvorbo plinastega kisika in vode.
- V reakciji razgradnje kalijevega klorata za proizvodnjo plinastega kisika in kalijevega klorida.
- Raztopljen v acetonu ali diklorometanu, primarne alkohole oksidira v aldehide in sekundarne ketone.
- Proizvodnja alkalnih baterij.
Kot katalizator
To velja za reakcije redukcije oksidov, za odstranitev sulfidov, kot je H2S in kationi, kot je Fe+2 in Mn+2 , arzen in radio v podzemni vodi, ki sta onesnaženi s to vrsto spojin.
To onesnaženje lahko povzroči nenadzorovano odlaganje strupenih snovi, pranje kontaminirane zemlje ali prisotnost kemičnih elementov v času pridobivanja vode..
MnO2 Visoka čistost, pridobljena iz piroluzita, ki se uporablja kot filter (Filox), je najučinkovitejše sredstvo za odstranitev tega razreda nečistoč iz podzemne vode..
Vplivi na zdravje
- Izogibajte se stiku s kožo.
- V primeru stika operite ustrezno območje.
- Ne vdihujte praškov.
- Draženje in rdečina sta vidni pri stiku z očmi. Operite z obilo vode, pustite, da voda teče skozi oči in v primeru resnih težav pokličite zdravnika.
- Pri stiku s kožo opazimo draženje in rdečino. Umijte prizadeto območje z veliko vode in milom.
- Daljši stik s kožo odstrani vašo naravno maščobo in sproži dermatitis.
- Vdihavanje lahko povzroči gripi podobno stanje (kovinski hlapi). Za to bolezen je značilna visoka vročina, mrzlica, suha usta in grlo, bolečine v mišicah in glavobol.
- Lahko draži dihala in poveča pojavnost okužb dihal (pljučnice). Intoksikacija z absorpcijo anorganskih manganovih soli skozi pljuča je malo verjetna, vendar se lahko pojavi kronična zastrupitev..
- Kronična izpostavljenost prahu ali hlapom iz manganovega dioksida v daljšem obdobju lahko vpliva na centralni živčni sistem in povzroči razvoj Parkinsonove bolezni, težav s hojo, mišičnih krčev in vedenjskih sprememb..
- Zaužitje lahko povzroči bolečine v trebuhu in slabost.
- Ni vnetljiv, vendar pomaga širiti ogenj v žarečih materialih. Če se segreje na temperaturo nad 535 ° C, se snov razgradi na manganov oksid (III) Mn2O3 in kisika, ki je vnetljiv in poveča nevarnost požara. V tem primeru je treba ogenj pogasiti s peno ali ogljikovim dioksidom.
- V primeru razlitja ne mešajte spojine brez ustrezne osebne zaščite.
- Skladiščite v tesno zaprtih posodah, na hladnem in suhem mestu in stran od nezdružljivih snovi, kot so organski materiali in gorljivi materiali.
- Skladiščni prostor mora biti suh in imeti tla, odporna na kislo korozijo in z dobro drenažo..
- Uporabiti je treba osebno zaščitno opremo, kot so rokavice, zaščitna očala, zaščitne maske proti prahu, prah in dim.
Reference
- B, (2015), manganov dioksid, Royal Society of Chemistry - svet kemije, pridobljeno iz chemistryworld.com
- Karal, (2014), Mangneso dioksid, varnostni list, izterjan iz, karal.com.mx
- Vaš virtualni učitelj (2015-02-25). Manganove anorganske spojine (posebni primer 1) - Teoretična lekcija), pridobljeno iz, youtube.com
- Ecured, (s.f), manganov dioksid, izterjan iz ecured.cu
- Angarita G, Johnny., (2017), manganov dioksid: izjemna tehnologija. Hydrotec, izterjal iz hydrotecocr.com
- Fernández, G., (2015), MnO manganov dioksid2/ aceton, Organska kemija, Obnovljeno iz quimicaorganica.net
- Tronox, (2011), manganov dioksid, varnostni list, izterjan iz, tronox.com


