Struktura, lastnosti in uporaba berilijevega oksida (BeO)
The berilijev oksid (BeO) je keramični material, ki ima poleg visoke trdnosti in električne upornosti visoko toplotno prevodno zmogljivost, zaradi česar je del jedrskih reaktorjev, kar presega celo kovine v tej zadnji lasti..
Poleg uporabnosti kot sintetičnega materiala ga lahko najdemo tudi v naravi, čeprav je redka. Njeno upravljanje mora biti skrbno izvedeno, saj lahko resno škoduje zdravju ljudi.
V sodobnem svetu so opazili, kako so znanstveniki, povezani s tehnološkimi podjetji, izvajali raziskave za razvoj naprednih materialov za zelo specializirane aplikacije, kot so tiste, ki so v skladu s polprevodniškimi materiali in tistimi v vesoljski industriji..
Posledica tega je bilo odkritje snovi, ki so nam zaradi svojih izjemno uporabnih lastnosti in visoke trajnosti dali priložnost za napredovanje v času, kar nam omogoča, da svojo tehnologijo prenesemo na višje ravni..
Indeks
- 1 Kemijska struktura
- 2 Lastnosti
- 2.1 Električna prevodnost
- 2.2 Toplotna prevodnost
- 2.3 Optične lastnosti
- 2.4 Tveganja za zdravje
- 3 Uporabe
- 3.1 Elektronske aplikacije
- 3.2 Jedrske aplikacije
- 3.3 Druge aplikacije
- 4 Reference
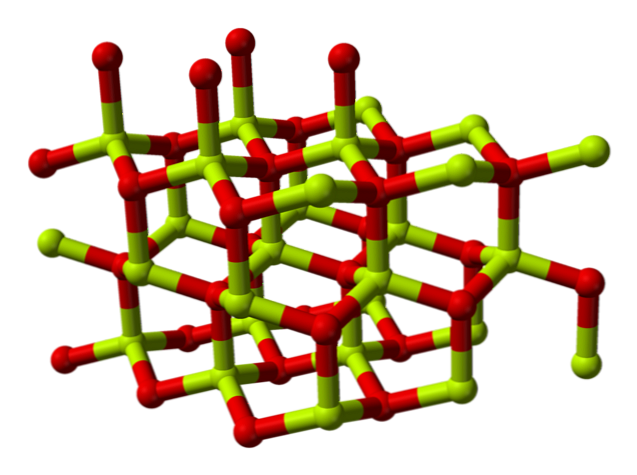
Kemijska struktura
Molekula berilijevega oksida (imenovana tudi "Berilia") Sestavljen je iz berilijevega atoma in atoma kisika, ki sta usklajena v tetraedrični orientaciji in kristalizirana v heksagonalnih kristalnih strukturah, imenovanih wurtzites.
Ti kristali imajo tetraedrske centre, ki jih zaseda Be2+ in O2-. Pri visokih temperaturah struktura berilijevega oksida postane tetragonalna.
Pridobivanje berilijevega oksida se doseže s tremi metodami: kalcinacijo berilijevega karbonata, dehidracijo berilijevega hidroksida ali vžig berilijeve kovine. Berilijev oksid, ki se tvori pri visokih temperaturah, je inerten, vendar ga lahko raztopimo z več spojinami.
BeCO3 + Toplota → BeO + CO2 (Žganje)
Be (OH)2 → BeO + H2O (dehidracija)
2 Be + O2 → 2 BeO (vžig)
Končno se berilijev oksid lahko upari in v tem stanju bo predstavljen v obliki diatomskih molekul..
Lastnosti
Berilijev oksid se v naravi pojavlja kot bromelit, beli mineral, ki ga najdemo v nekaterih kompleksnih usedlinah manganovega železa, vendar je bolj pogosto v sintetični obliki: bela amorfna trdna snov, ki se proizvaja v obliki praška..
Tudi nečistoče, ki so bile ujete med proizvodnjo, bodo vzorcu oksida ponudile različne barve.
Tališče je 2507 ° C, vrelišče je 3900 ° C in ima gostoto 3,01 g / cm.3.
Na enak način je njegova kemijska stabilnost precej visoka, reagira le z vodno paro pri temperaturah blizu 1000 ° C in se lahko upre procesom redukcije ogljika in napadom staljenih kovin pri visokih temperaturah..
Poleg tega je njegova mehanska trdnost dostojna in jo je mogoče izboljšati z načrti in proizvodnjo, ki so primerni za komercialno uporabo.
Električna prevodnost
Berilijev oksid je zelo stabilen keramični material in ima zato precej visoko električno upornost, zaradi česar je eden od najboljših električnih izolacijskih materialov, skupaj z aluminijevim oksidom..
Zaradi tega se ta material pogosto uporablja za specializirano visokofrekvenčno električno opremo.
Toplotna prevodnost
Berilijev oksid ima veliko prednost glede toplotne prevodnosti: znan je kot drugi najboljši toplotno prevodni material med nekovinami, ki ga presega le diamant, material, ki je precej dražji in redkejši.
Kar se tiče kovin, le bakra in srebra bolje prenašajo toploto kot pa berilijev oksid, zaradi česar je zelo zaželen material.
Zaradi svojih odličnih toplotno prevodnih lastnosti je ta snov vključena v proizvodnjo ognjevzdržnih materialov.
Optične lastnosti
Zaradi svojih kristalnih lastnosti se berilijev oksid uporablja za nanašanje prozornega materiala na ultravijolično svetlobo v nekaterih ravnih zaslonih in fotovoltaičnih celicah..
Prav tako lahko izdelamo kristale zelo visoke kakovosti, tako da se te lastnosti izboljšajo glede na uporabljeni proizvodni proces.
Tveganja za zdravje
Berilijev oksid je spojina, s katero je treba ravnati previdno, saj ima najprej rakotvorne lastnosti, ki so povezane z neprekinjenim vdihavanjem prahov ali hlapov tega materiala..
Majhni delci v teh fazah oksida se držijo pljuč in lahko povzročijo nastanek tumorjev ali bolezni, znane kot berilioza..
Berilioza je bolezen s srednjo stopnjo smrtnosti, ki povzroča neučinkovito dihanje, kašelj, izgubo telesne teže in zvišano telesno temperaturo ter nastanek granulomov v pljučih ali drugih prizadetih organih..
Obstajajo tudi nevarnosti za zdravje zaradi neposrednega stika berilijevega oksida s kožo, saj je jedko in dražilno in lahko povzroči poškodbe površine kože in sluznice. Pri delu s tem materialom, zlasti v obliki prahu, je treba zaščititi dihalne poti in roke.
Uporabe
Uporaba berilijevega oksida se večinoma razdeli na tri: elektronske, jedrske in druge aplikacije.
Elektronske aplikacije
Zmožnost prenosa toplote na visoko raven in dobra električna upornost je povzročila, da berilijev oksid pridobi veliko korist kot toplotni odvod..
Njegova uporaba je bila dokazana v vezjih znotraj visoko zmogljivih računalnikov, poleg opreme, ki obdeluje visoke tokove električne energije.
Berilijev oksid je transparenten za rentgenske žarke in mikrovalovne pečice, zato se uporablja v oknih proti tem vrstam sevanja, kot tudi antene, komunikacijski sistemi in mikrovalovne pečice..
Jedrske aplikacije
Njegova zmožnost ublažitve nevtronov in vzdrževanje njene strukture pri bombardiranju sevanja je povzročila, da je berilijev oksid vključen v gradnjo jedrskih reaktorjev in se lahko uporablja tudi pri visokotemperaturnih reaktorjih, hlajenih s plini..
Druge aplikacije
Nizka gostota berilijevega oksida je vzbudila zanimanje za letalsko in vojaško tehnološko industrijo, saj lahko predstavlja rahlo teže v raketnih motorjih in neprebojnih jopičih..
Nazadnje je bil nedavno uporabljen kot ognjevzdržni material pri zlitju kovin v metalurški industriji.
Reference
- PubChem. (s.f.). Berilijev oksid. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov
- Reade. (s.f.). Beryllia / Berilijev oksid (BeO). Izterjano iz reade.com
- Raziskave, C. (s.f.). Berilijev oksid - Berilija. Vzpostavljeno iz azom.com
- Services, N.J. (s.f.). Berilijev oksid. Vzpostavljeno iz nj.gov
- Wikipedija. (s.f.). Berilijev oksid. Vzpostavljeno iz en.wikipedia.org


