Lastnosti bakrovega sulfida, tveganja in uporaba
The bakrovih sulfidov opisujejo družino kemičnih spojin in mineralov s formulo CuxSin. Te spojine obsegajo ekonomsko pomembne minerale in sintetične materiale.
Med najpomembnejšimi minerali bakrovega sulfida so bakrov sulfid (I) ali bakrov sulfid kemijske formule.2S v mineralnih kalcijevih in bakrovih sulfidih (II) ali bakrovih sulfidih, s formulo CuS, ki jo najdemo v koevskem mineralu.
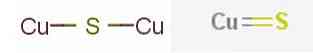
Calcosine se že stoletja ekstrahira in je ena najbolj donosnih bakrovih rud. Razlogi za to so visoka vsebnost bakra (atomsko razmerje 67% in skoraj 80% mase) in enostavnost ločevanja bakra od žvepla..
Vendar pa zaradi svojega pomanjkanja ni glavni bakreni mineral. Čeprav so bila najbogatejša kalcinirana nahajališča, je verjetno še vedno izkopana in bo v prihodnosti minirana (MINERALNA ČALCOCITA, 2014).

Covelite ni porazdeljen mineral, toda njegovi mavrični čari lahko očarajo občudovanje vsakogar, ki vidi indigo modre kristale. Čeprav so dobri kristali redki, je zaradi sijaja in barve tega minerala izjemen (MINERALNA COVELITA, 2014).

V rudarski industriji se minerali bornite ali kalkoprita, ki so sestavljeni iz mešanih bakrovih in železovih sulfidov, pogosto imenujejo "bakrovi sulfidi"..
V kemiji je "binarni bakrov sulfid" katerakoli binarna kemična spojina elementov bakra in žvepla. Ne glede na njegov vir se bakrovi sulfidi zelo razlikujejo po sestavi z 0,5 ≤ Cu / S ≤ 2, vključno s številnimi nestehiometričnimi spojinami.
Indeks
- 1 Fizikalne in kemijske lastnosti bakrovih sulfidov
- 2 Reaktivnost in nevarnosti
- 3 Uporabe
- 4 Reference
Fizikalne in kemijske lastnosti bakrovih sulfidov
Bakreni sulfid (I) in (II) imata podoben videz, saj sta oba kristala temna, siva ali črna.

Te spojine se lahko razlikujejo po kristalni strukturi. Bakrov sulfid (I) ima monoklinsko strukturo, bakrov (II) sulfid pa ima šesterokotno strukturo (Nacionalni center za biotehnološke informacije, S.F.).
Imajo molekulsko maso 159,16 g / mol in 95,611 g / mol in gostoto 5,6 g / ml in 4,76 g / ml za primer bakrovega sulfida (I) oziroma (II) (nacionalni center za Biotehnološke informacije, SF).
Bakrov sulfid (I) ima tališče 1100 ° C in je netopen v vodi in ocetni kislini, saj je delno topen v amonijevem hidroksidu (Royal Society of Chemistry, 2015)..
Bakrov (II) sulfid ima tališče 220 ° C, kadar se razgradi, je netopen v vodi, klorovodikovi in žveplovi kislini ter je topen v dušikovi kislini, amonijevem hidroksidu in kalijevem cianidu (Royal Society of Chemistry, 2015). ).
Vodikov peroksid odločno reagira s bakrovim (II) sulfidom in eksplodira ob stiku s koncentrirano raztopino klorove kisline ali kadmijevih, magnezijevih ali cinkovih kloratov..
Reaktivnost in nevarnosti
Bakrovi sulfidi (I) in (II) niso razvrščeni kot nevarni, vendar so lahko strupeni, če se zaužijejo zaradi proizvodnje vodikovega sulfida. Simptomi vključujejo bruhanje, želodčne bolečine in omotico, lahko povzročijo draženje kože in oči, vdihavanje pa lahko povzroči draženje dihalnih poti (VARNOSTNI LIST Copper Sulfide, 1995).
V primeru, da je izpostavljen toploti, lahko sprosti strupene pare žvepla ali bakrovega oksida, ki so lahko škodljive za zdravje.
Če pride v stik z očmi, jih je treba takoj sprati z zadostno količino vode 15 minut, občasno dvigniti spodnje in zgornje veke..
V primeru stika s kožo takoj izperite z zadostno količino vode 15 minut, medtem ko odstranjujete kontaminirana oblačila..
V primeru zaužitja je treba takoj poklicati center za nadzor zastrupitev. Usta izperite s hladno vodo in pijačo pijte 1-2 skodelici vode ali mleka. Bruhanje je treba takoj sprožiti.
V primeru vdihavanja je treba žrtev peljati na hladno mesto. Če ne diha, dajte umetno dihanje (Baker (II) Sulfide, 2009).
Uporabe
Bakrov sulfid (I) se uporablja kot polprevodnik in za fotografske aplikacije (americanelements, 1998-2017). Njegova uporaba vključuje tudi uporabo v sončnih celicah, svetlečih barvah, elektrodah in nekaterih sortah trdnih maziv (Britannica, 2013).
Po drugi strani pa bakrov sulfid (II) najde aplikacije v sončnih celicah, superionskih vodnikih, fotodetektorjih, elektroprevodnih elektrodah, fototermičnih pretvornikih, mikrovalovnih zaščitnih prevlekah, aktivnih absorberjih radijskih valov, plinskih senzorjev in polarizatorjev sevanja. infrardeča povezava (azom, 2013).
Tudi bakrov (II) sulfid (koelit) se uporablja pri študiji nanodelcev:
- Z različnimi postopki izdelave (solvotermalne poti, aerosolne metode, metode raztopin in termoliza)
- In aplikacije (fotokatalitska razgradnja, ablacija rakavih celic, elektrodni material v litij-ionskih baterijah in plinskem senzorju, lastnosti emisij na polju, aplikacije super kondenzatorjev, fotoelektrokemična učinkovitost QDSC, fotokatalitska redukcija organskih onesnaževal, bio- elektrokemijsko zaznavanje, izboljšane PEC lastnosti predkuhanih CuS film elektrod) (Umair Shamraiz, 2016).
V delu Geng Ku (2012) je bila prikazana uporaba polprevodniških nanodelcev bakrovega sulfida (CuS NPs) za vizualizacijo fotoakustičnih tomografij z Nd: YAG laserjem pri valovni dolžini 1064 nm..
CuS NP je omogočil vizualizacijo mišjih možganov po intrakranialni injekciji, 12 mm pod kožo po intersticijskem injiciranju in agaroznem gelu, ki je vseboval CuS NP v mišicah piščančjih prs. na globini ~ 5 cm. Ta pristop s slikami ima velik potencial za pridobitev molekularne podobe raka dojk.
Reference
- (1998–2017). Baker (I) sulfid. Vzpostavljeno iz americanelements.com.
- (2013, 19. april). Polprevodniki iz bakrovega sulfida (CuS). Vzpostavljeno iz azom.com.
- Britannica, T. E. (2013, 23. avgust). Baker (Cu). Vzpostavljeno iz britannica.com.
- Baker (II) sulfid. (2009, 23. januar). Vzpostavljeno iz onboces.org.
- Geng Ku, M. Z. (2012). Nanodelci bakrovih sulfidov Kot nov razred fotoakustičnega kontrastnega sredstva za globinsko slikanje tkiv pri 1064 nm. ACS Nano 6 (8), 7489-7496.
- PODATKOVNI LIST O VARNOSTI MATERIALA Bakrov sulfid. (1995, november). Vzpostavljeno iz onboces.org.
- Nacionalni center za biotehnološke informacije. (S.F.). PubChem Compound Database; CID = 14831. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov.
- Nacionalni center za biotehnološke informacije. (S.F.). PubChem Compound Database; CID = 62755. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Baker (II) sulfid. Vzpostavljeno iz chemspider.com.
- Royal Society of Chemistry. (2015). Dicopper (1+) sulfid. Vzpostavljeno iz chemspider.com.
- MINERALNI CHALCOCITE. (2014). Vzpostavljeno iz galleries.com.
- MINERALNA COVELLITE. (2014). Vzpostavljeno iz galleries.com.
- Umair Shamraiz, R. A. (2016). Izdelava in uporaba nanostruktur bakrovih sulfidov (CuS). Revija za kemijo trdne snovi, zvezek 238, 25-40.


