Eksotermni reakcijski proces, vrste in primeri
The eksotermne reakcije je vrsta kemijske reakcije, pri kateri pride do prenosa energije, predvsem v obliki sproščanja toplote ali svetlobe. Ime izhaja iz grške predpone exo, kar pomeni "v tujini"; in izraz "toplotna", ki se nanaša na toploto ali temperaturo.
V tem smislu lahko eksotermne reakcije prenesejo druge vrste energije v okolje, v katerem nastanejo, na primer z eksplozijami in načinom prenosa kinetične in zvočne energije, kadar so snovi, ki so v plinasti fazi pri visokih temperaturah, razširjene. nasilen način.
Na enak način se v primeru uporabe baterij izvede tudi eksotermna reakcija, le v tem primeru se prenaša električna energija..
Indeks
- 1 Postopek
- 2 Vrste
- 2.1 Reakcije zgorevanja
- 2.2 Nevtralizacijske reakcije
- 2.3 Oksidacijske reakcije
- 2.4 Reakcija termitov
- 2.5 Reakcijska polimerizacija
- 2.6 Reakcija jedrske fisije
- 2.7 Druge reakcije
- 3 Primeri
- 4 Reference
Proces
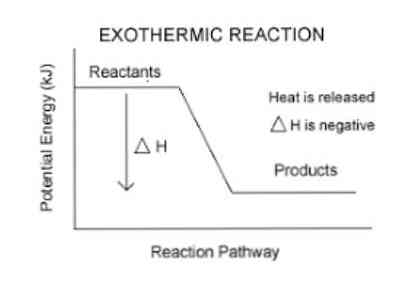
Prej je bilo omenjeno, da pri eksotermni reakciji pride do sproščanja energije, ki se lahko lažje vizualizira v naslednji enačbi:
Reagenti (i) → Proizvod (i) + energija
Za kvantifikacijo energije, ki jo absorbira ali sprosti sistem, je uporabljen termodinamični parameter, imenovan entalpija (označen s "H"). Če je v sistemu (v tem primeru kemijska reakcija) v okolico izpuščena energija, bo sprememba entalpije (izražena kot ΔH) imela negativno vrednost.
V nasprotnem primeru, če je sprememba tega ukrepa pozitivna, odraža absorpcijo toplote iz okolice. Tudi velikost spremembe entalpije sistema je izraz količine energije, ki se prenese v okolje ali iz njega..
Večja kot je velikost ΔH, večja je izpust energije iz sistema v okoliški medij.
To je zato, ker je v teh reakcijah neto energija, ki se sprosti ob ustvarjanju novih povezav, večja od neto energije, uporabljene pri razdrobljenosti povezav..
Iz zgoraj navedenega lahko sklepamo, da je ta vrsta reakcij zelo pogosta, ker imajo produkti reakcije količino energije, shranjene v vezih, ki je večja od vsebnosti reaktantov..
Vrste
Obstajajo različne vrste eksotermnih reakcij na različnih področjih kemije, bodisi v laboratoriju ali v industriji; nekatere se izvajajo spontano, druge pa potrebujejo posebne pogoje ali neko vrsto snovi, kot je katalizator.
Najpomembnejše vrste eksotermnih reakcij so:
Reakcije zgorevanja
Reakcije zgorevanja so tiste z redoks tipom, ki nastanejo, ko ena ali več snovi reagira s kisikom, kar na splošno povzroči sproščanje svetlobe in toplotne energije, to je svetlobe in toplote, ko nastane plamen..
Nevtralizacijske reakcije
Nevtralizacijske reakcije so označene z interakcijo med kislinsko vrsto in alkalno snovjo (bazo), da nastanejo sol in voda, ki imata eksotermno naravo..
Oksidacijske reakcije
Obstaja veliko takšnih reakcij, ki kažejo eksotermno obnašanje, saj oksidacija kisika povzroča sproščanje velike količine energije, kot se pojavi pri oksidaciji ogljikovodikov..
Termitna reakcija
Ta reakcija lahko povzroči temperaturo približno 3000 ° C, zaradi visoke afinitete aluminijevega prahu z velikim številom kovinskih oksidov pa se uporablja pri varjenju jekla in železa..
Reakcija polimerizacije
Ta vrsta reakcije je tista, ki izvira, ko reagira določeno število kemičnih vrst, imenovanih monomeri, ki so enote, ki se v kombinaciji ponavljajo v verigah, da tvorijo makromolekularne strukture, imenovane polimeri..
Reakcija jedrske fisije
Ta postopek se nanaša na delitev jedra atoma, ki se šteje za težko - to je z masno številko (A), večjo od 200 -, da se pridobijo fragmenti ali jedra manjše velikosti z vmesno maso..
V tej reakciji, kjer nastane eden ali več nevtronov, se sprosti velika količina energije, ker ima jedro z večjo težo manjšo stabilnost kot njegovi izdelki..
Druge reakcije
Obstajajo tudi druge eksotermne reakcije, ki so zelo pomembne, kot je dehidracija nekaterih ogljikovih hidratov pri reakciji z žveplovo kislino, absorpcija vode, ki ima natrijev hidroksid izpostavljen na prostem ali oksidacija kovinskih vrst v mnogih korozijskih reakcijah..
Primeri
Spodaj je navedenih nekaj primerov eksotermnih reakcij, ki povzročajo spremembo entalpije, ki ima negativno vrednost zaradi dejstva, da sproščajo energijo, kot je navedeno zgoraj..
Na primer, zgorevanje propana je spontana eksotermna reakcija:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O (l)
Drugi primer eksotermnega obnašanja se kaže v reakciji nevtralizacije med natrijevim karbonatom in klorovodikovo kislino:
NaHCO3(ac) + HCl (ac) → NaCl (ac) + H2O (l) + CO2(g)
Predstavljena je tudi oksidacija etanola v ocetno kislino, ki se uporablja v inhalatorjih, katere popolna reakcija je prikazana v naslednji enačbi:
3CH3CH2OH + 2K2Cr2O7 + 8H2SO4 → CH3COOH + 2Cr (SO4)3 + 2K2SO4 + 11H2O
Druga vrsta eksotermne reakcije je tako imenovana termitna reakcija, pri kateri se aluminij kombinira s kovinskim oksidom, kot je prikazano spodaj:
2Al + Vera2O3(s) → Al2O3(s) + Fe (l)
Poleg zgoraj pojasnjenih primerov obstaja tudi veliko različnih reakcij, ki so tudi eksotermne, kot je razgradnja nekaterih organskih odpadnih snovi za kompostiranje..
Poudarja tudi oksidacijo luciferinovega pigmenta z delovanjem encima luciferaze, da se proizvede bioluminiscenčna značilnost kresnic in celo dihanje, med številnimi drugimi reakcijami..
Reference
- Wikipedija. (s.f.). Eksotermna reakcija. Vzpostavljeno iz es.wikipedia.org
- BBC (s.f.). Energetske spremembe in reverzibilne reakcije. Vzpostavljeno iz bbc.co.uk
- Chang, R. (2007). Kemija, 9. izdaja. (McGraw-Hill).
- Walker, D. (2007). Kemijske reakcije. Vzpostavljeno iz books.google.co.ve
- Saunders, N. (2007). Raziskovanje kemijskih reakcij. Vzpostavljeno iz books.google.co.ve


