Lastnosti endotermnih reakcij, enačbe in primeri
Ena endotermna reakcija To je tisto, kar mora potekati, da absorbira energijo, v obliki toplote ali sevanja, iz okolice. Na splošno, čeprav ne vedno, jih je mogoče prepoznati s padcem temperature v njihovem okolju; ali pa ravno nasprotno, potrebujejo vir toplote, kot je tisti, ki ga dobimo z gorečim plamenom.
Absorpcija energije ali toplote je skupna vsem endotermnim reakcijam; Narava enakega, kot tudi vključene transformacije, je zelo raznolika. Koliko toplote naj absorbirajo? Odgovor je odvisen od njegove termodinamike: temperature, pri kateri se reakcija pojavi spontano.

Na primer, ena najbolj emblematičnih endotermnih reakcij je sprememba stanja od ledu do tekoče vode. Led mora absorbirati toploto, dokler temperatura ne doseže približno 0 ° C; pri tej temperaturi postane njeno taljenje spontano in led se absorbira, dokler se popolnoma ne stopi.
V vročih prostorih, kot so na obali plaže, so temperature višje in zato led hitreje absorbira toploto; to pomeni, da se topi z večjo hitrostjo. Taljenje ledenikov je primer nezaželene endotermne reakcije.
Zakaj se to zgodi tako? Zakaj ni mogoče predstaviti ledu kot vročo trdno snov? Odgovor leži v povprečni kinetični energiji molekul vode v obeh državah in kako medsebojno delujejo med seboj prek svojih vodikovih vezi..
V tekoči vodi imajo njene molekule večjo svobodo gibanja kot v ledu, kjer vibrirajo v svojih kristalih. Da bi se premaknile, morajo molekule absorbirati energijo tako, da njihove vibracije razbijejo močne usmerjene vodikove mostove v ledu.
Zaradi tega led absorbira toploto, da se tali. Da bi obstajal "vroč led", bi morali biti vodikovi mostovi nenavadno močni, da bi se topili pri temperaturi nad 0 ° C.
Indeks
- 1 Značilnosti endotermne reakcije
- 1,1 ΔH> 0
- 1.2 Ohladite okolico
- 2 Enačbe
- 3 Primeri pogostih endotermnih reakcij
- 3.1 Izhlapevanje suhega ledu
- 3.2 Pečenje kruha ali kuhanje hrane
- 3.3 sončenje
- 3.4 Reakcija atmosferskega dušika in tvorbe ozona
- 3.5 Elektroliza vode
- 3.6 Fotosinteza
- 3.7 Raztopine nekaterih soli
- 3.8 Termična razgradnja
- 3.9 Amonijev klorid v vodi
- 3.10 Natrijev triosulfat
- 3.11 Avtomobilski motorji
- 3.12 vrele tekočine
- 3.13 Kuhanje jajc
- 3.14 Kuhanje hrane
- 3.15 Ogrevanje hrane v mikrovalovni pečici
- 3.16 Oblikovanje stekla
- 3.17 Poraba sveče
- 3.18 Čiščenje z vročo vodo
- 3.19 Toplotna sterilizacija hrane in drugih predmetov
- 3.20 Boj proti okužbam z vročino
- 3.21 Izhlapevanje vode
- 4 Reference
Značilnosti endotermne reakcije
Sprememba stanja ni ustrezno kemična reakcija; vendar se zgodi enako: izdelek (tekoča voda) ima več energije kot reaktant (led). To je glavna značilnost reakcijskega ali endotermnega procesa: proizvodi so bolj energični kot reaktanti.
Čeprav je to res, to ne pomeni, da morajo biti izdelki nujno nestabilni. V primeru, da je, endotermna reakcija preneha spontano v vseh pogojih temperature ali tlaka.
Razmislite o naslednji kemijski enačbi:
A + Q => B
Kjer Q predstavlja toploto, običajno izraženo z enotami džula (J) ali kalorij (kal). Ker A absorbira toploto Q, da se preoblikuje v B, potem je rečeno, da gre za endotermno reakcijo. Tako ima B več energije kot A in mora absorbirati dovolj energije, da doseže svojo transformacijo.
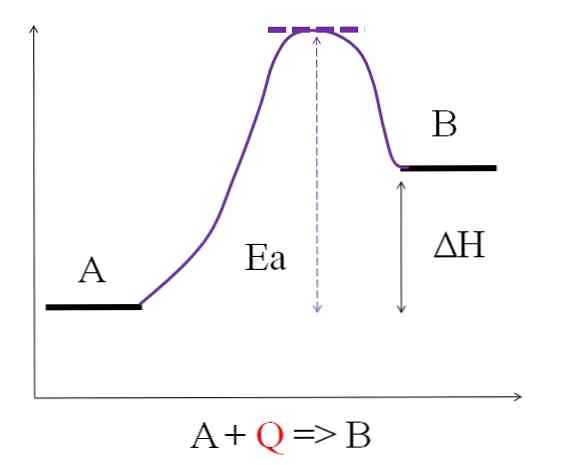
Kot je razvidno iz zgornjega diagrama, ima A manj energije kot B. Količina toplote Q, ki se absorbira, je taka, da premaga aktivacijsko energijo (energijo, potrebno za dosego vijoličnega vrha s pikčasto streho). Energetska razlika med A in B je tista, ki je znana kot entalpija reakcije, ΔH.
ΔH> 0
Vse endotermne reakcije so skupne prejšnjemu diagramu, saj so proizvodi bolj energični kot reaktanti. Zato je razlika v energiji med njimi ΔH vedno pozitivna (HIzdelek-HReagent > 0). Ko je to res, mora biti absorpcija toplote ali energije iz okolice za oskrbo te energetske potrebe.
In kako se takšni izrazi razlagajo? V kemijski reakciji so povezave vedno zlomljene, da ustvarijo druge. Da bi jih razbili, je potrebna absorpcija energije; to je endotermni prehod. Medtem pa oblikovanje povezav pomeni stabilnost, zato je to eksotermni korak.
Kadar nastale vezi ne zagotavljajo stabilnosti, primerljive s količino energije, ki je potrebna za prekinitev starih vezi, je to endotermična reakcija. Zato je potrebna dodatna energija za pospeševanje prekinitve najbolj stabilnih vezi v reagentih.
Po drugi strani se pri eksotermnih reakcijah pojavi nasprotno: toplota se sprosti in ΔH je < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Ohlajajo svojo okolico
Čeprav ne velja za vse endotermne reakcije, večina povzroči zmanjšanje temperature okolice. To je zato, ker absorbirana toplota prihaja od nekje. Če bi se pretvorba A in B prenesla v posodo, bi se ohladila.
Bolj ko je reakcija endotermična, bo hladnejši vsebnik in njegova okolica. Pravzaprav lahko nekatere reakcije tvorijo tudi tanek ledeni pokrov, kot da bi prišel iz hladilnika.
Vendar pa obstajajo reakcije te vrste, ki ne hladijo svoje okolice. Zakaj? Ker je toplota okolice nezadostna; to pomeni, da ne zagotavlja potrebnega Q (J, cal), ki je zapisano v kemijskih enačbah. Zato je tu, ko pride do požara ali ultravijoličnega sevanja.
Med obema scenarijema lahko pride do majhne zmede. Po eni strani je toplota okolice dovolj za spontano nadaljevanje reakcije in opazovanje hlajenja; po drugi strani pa je potrebno več toplote in se uporablja učinkovita metoda ogrevanja. V obeh primerih se zgodi enako: energija se absorbira.
Enačbe
Kakšne so ustrezne enačbe v endotermni reakciji? Kot je že bilo pojasnjeno, mora biti ΔH pozitivna. Da bi jo izračunali, se najprej upošteva naslednja kemijska enačba:
aA + bB => cC + dD
Kadar sta A in B reaktantne snovi, C in D pa sta proizvoda. Mala črka (a, b, c in d) so stehiometrični koeficienti. Za izračun ΔH te generične reakcije se uporabi naslednji matematični izraz:
ΔHIzdelki- ΔHReagenti = ΔHrxn
Lahko nadaljujete neposredno ali izračune ločeno. Za ΔHIzdelki izračunati je treba naslednji znesek:
c ΔHfC + d AHfD
Kjer je ΔHf to je entalpija tvorbe vsake snovi, vključene v reakcijo. Po dogovoru imajo snovi v svojih najbolj stabilnih oblikah ΔHf= 0 Na primer O molekule2 in H2, ali trdne kovine, imajo ΔHf= 0.
Enak izračun je zdaj narejen za reaktante ΔHReagenti:
do ΔHfA + b ΔHfB
Ampak kot enačba pravi, da je ΔHReagenti od ΔHIzdelki, potem se mora prejšnji znesek pomnožiti z -1. Torej imate:
c ΔHfC + d AHfD - (do ΔHfA + b ΔHfB)
Če je rezultat tega izračuna pozitivno število, je to endotermna reakcija. Če je negativna, je to eksotermna reakcija.
Primeri pogostih endotermnih reakcij
Izhlapevanje suhega ledu

Kdor je videl tiste bele hlape, ki izvirajo iz vozička za sladoled, je bil priča eni izmed najpogostejših primerov endotermne "reakcije"..
Poleg nekaj sladoledov so ti hlapi, ločeni od trdne bele barve, imenovani suhi led, prav tako del scenarijev za ustvarjanje učinka meglice. Ta suhi led ni nič drugega kot trden ogljikov dioksid, ki absorbira temperaturo in preden se zunanji tlak začne sublimirati.
Poskus za otrokovo občinstvo bi bil zapolniti in zapečatiti vrečko s suhim ledom. Čez nekaj časa se bo na koncu napihnilo zaradi CO2 plinasto, ki ustvarja delo ali stisne notranje stene vrečke pred atmosferskim tlakom.
Peka kruha ali kuhanje hrane

Pečenje kruha je primer kemične reakcije, saj so zaradi toplote zdaj prisotne kemijske spremembe. Kdor koli diši po sveže pečenem kruhu, ve, da se pojavi endotermna reakcija.
Testo in vse njegove sestavine potrebujejo toploto pečice za izvedbo vseh transformacij, ki so nepogrešljive, da postanejo kruh in imajo značilne lastnosti.
Poleg kruha je kuhinja polna primerov endotermnih reakcij. Kdo jih kuha vsakodnevno. Kuhanje testenin, mehčanje zrna, segrevanje zrnja koruze, pečenje jajc, začimbno meso, pečenje pogače, priprava čaja, ogrevanje sendvičev; vsaka od teh dejavnosti je endotermna reakcija.
Sončenje

Kot se zdi preprosto in skupno, sončenje, ki ga jemljejo nekateri plazilci, kot so želve in krokodili, spadajo v kategorijo endotermnih reakcij. Želve absorbirajo toploto sonca, da uravnavajo temperaturo svojega organizma.
Brez sonca zadržujejo toploto vode, da se ogreje; kar na koncu ohladi vodo v rezervoarjih ali akvarijih.
Reakcija atmosferskega dušika in tvorbe ozona

Zrak je v glavnem sestavljen iz dušika in kisika. Med nevihtami se sprosti energija, ki lahko razbije močne vezi, ki zadržujejo dušikove atome skupaj v N-molekuli.2:
N2 + O2 + Q => 2NO
Po drugi strani pa lahko kisik absorbira ultravijolično sevanje, da postane ozon; alotropnost kisika, ki je zelo koristna v stratosferi, vendar škoduje življenju na tleh. Reakcija je:
3O2 + v => 2O3
Kjer v pomeni ultravijolično sevanje. Mehanizem za to preprosto enačbo je zelo zapleten.
Elektroliza vode
Elektroliza uporablja električno energijo za ločevanje molekule v njenih elementih ali oblikovanje molekul. Na primer, pri elektrolizi vode nastajajo dva plina: vodik in kisik, vsak v različnih elektrodah:
2H2O => 2H2 + O2
Tudi natrijev klorid lahko trpi za isto reakcijo: \ t
2NaCl => 2Na + Cl2
V eni elektrodi boste videli tvorbo kovinskega natrija, v drugih pa zelenkaste mehurčke klora.
Fotosinteza

Rastline in drevesa morajo absorbirati sončno svetlobo kot vir energije, da sintetizirajo svoje biomateriale. Za to uporablja CO kot surovino2 in voda, ki se skozi dolg niz korakov spremeni v glukozo in druge sladkorje. Poleg tega nastane kisik, ki se sprosti iz listov.
Raztopine nekaterih soli
Če se natrijev klorid raztopi v vodi, ne opazimo opazne spremembe zunanje temperature posode ali posode..
Nekaj soli, kot je kalcijev klorid, CaCl2, poveča temperaturo vode kot produkt velike hidracije Ca ionov2+. In druge soli, kot je nitrat ali amonijev klorid, NH4Št3 in NH4Cl, zmanjšajte temperaturo vode in ohladite okolico.
V učilnicah se običajno opravijo domači poskusi, da se raztopijo nekatere od teh soli, da se dokaže, kaj je endotermna reakcija.
Znižanje temperature je posledica hidracije ionov NH4+ ni prednost pred raztapljanjem kristalnih oblik njegovih soli. Zato soli absorbirajo toploto iz vode, da se omogoči solvat ionov.
Druga kemijska reakcija, ki je ponavadi zelo pogosta, je to:
Ba (OH)2· 8H2O + 2NH4Št3 => Ba (NO3)2 + 2NH3 +10H2O
Upoštevajte količino nastale vode. Z mešanjem obeh trdnih snovi dobimo vodno raztopino Ba (NO3)2, z vonjem amoniaka in s takšnim padcem temperature, ki dobesedno zmrzne zunanjo površino posode.
Termična razgradnja
Ena najpogostejših termičnih razgradenj je natrijev bikarbonat, NaHCO3, za proizvodnjo CO2 in vodo pri segrevanju. Številne trdne snovi, vključno karbonati, se nagibajo k razgradnji, da se sprosti CO2 in ustrezni oksid. Na primer, razgradnja kalcijevega karbonata je naslednja:
CaCO3 + Q => CaO + CO2
Enako velja za magnezijev, stroncijev in barijev karbonat.
Pomembno je omeniti, da je toplotna razgradnja drugačna od zgorevanja. V prvem ni prisotnosti vžiga ali se sprosti toplota, v drugem pa da; to pomeni, da je zgorevanje eksotermna reakcija, čeprav potrebuje začetni vir toplote, da se izvede ali pride spontano.
Amonijev klorid v vodi
Ko se majhna količina amonijevega klorida (NH4Cl) raztopi v vodi v epruveti, postane cev hladnejša kot prej. Med to kemijsko reakcijo se toplota absorbira iz okolja.
Natrijev triosulfat
Ko kristali natrijevega tiosulfata (Na2S2O3.5H2O), ki se običajno imenuje hypo, raztopi v vodi, pride do hladilnega učinka.
Avtomobilski motorji
Zgorevanje bencina ali dizelskega goriva v motorjih avtomobilov, tovornjakov, traktorjev ali avtobusov proizvaja mehansko energijo, ki se uporablja v prometu teh vozil..
Vrele tekočine
Z vstavljanjem tekočine v toploto pridobiva energijo in gre v plinasto stanje.
Kuhanje jajc
Ko se toplota uporabi, se jajčni proteini denaturirajo in tvorijo trdno strukturo, ki se običajno zaužije.
Kuhanje hrane
Na splošno se pri kuhanju s toploto spreminjajo lastnosti hrane, pri čemer se pojavijo endotermne reakcije.
Te reakcije povzročajo mehkejšo hrano, med drugim ustvarjajo temne mase, sproščajo sestavine, ki jih vsebujejo.
Ogrevanje hrane v mikrovalovni pečici
Z mikrovalovnim sevanjem molekule vode v hrani absorbirajo energijo, začnejo vibrirati in povečujejo temperaturo hrane.
Lito steklo
Zaradi absorpcije toplote s steklom so njihovi sklepi prožnejši, zaradi česar se njihova oblika lažje spreminja.
Poraba sveče
Vosek sveče se topi, saj absorbira toploto plamena in spreminja njegovo obliko.
Čiščenje z vročo vodo
Pri uporabi tople vode za čiščenje predmetov, ki so bili obarvani z mastjo, kot so lonci ali oblačila, postane mastnejša in jo je lažje odstraniti.
Toplotna sterilizacija hrane in drugih predmetov
Pri segrevanju predmetov ali hrane mikroorganizmi, ki jih vsebujejo, povečajo tudi svojo temperaturo.
Ko se dovoli veliko toplote, se pojavijo reakcije znotraj mikrobnih celic. Mnoge od teh reakcij, kot so lomljenje vezi ali denaturacija beljakovin, na koncu uničijo mikroorganizme.
Boj proti okužbam z vročino
Ko se vročina manifestira, je to zato, ker telo proizvaja potrebno toploto za ubijanje bakterij in virusov, ki povzročajo okužbe in povzročajo bolezni..
Če je proizvedena toplota visoka in visoka vročina, so prizadete tudi celice telesa in obstaja nevarnost smrti.
Izhlapevanje vode
Ko voda izhlapi in se pretvori v paro, je to posledica toplote, ki jo prejme iz okolja. Ker toplotna energija prejema vsaka molekula vode, se njena vibracijska energija povečuje do točke, kjer se lahko prosto giblje, kar ustvarja hlapi..
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija (8. izd.). CENGAGE Učenje.
- Wikipedija. (2018). Endotermični proces. Vzpostavljeno iz: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27. december 2018). Primeri endotermnih reakcij. Vzpostavljeno iz: thoughtco.com
- Khan Akademija. (2019). Endotermna proti eksotermne reakcije Vzpostavljeno iz: khanacademy.org
- Serm Murmson. (2019). Kaj se dogaja na molekularni ravni med endotermno reakcijo? Hearst Seattle Media. Vzpostavljeno iz: education.seattlepi.com
- QuimiTube. (2013). Izračun entalpije reakcije iz entalpij formacije. Vzpostavljeno iz: quimitube.com
- Quimicas.net (2018). Primeri endotermne reakcije. Vzpostavljeno iz:
quimicas.net.


