Kaj je nasičena raztopina? (s primeri)
Ena nasičene raztopine je kemijska raztopina, ki vsebuje največjo koncentracijo raztopljene raztopine v topilu. Šteje se za stanje dinamičnega ravnovesja, kjer so hitrosti, pri katerih topilo raztaplja topilo in hitrost prekristalizacije, enake (J., 2014).
Dodatna raztopina se ne bo raztopila v nasičeni raztopini in se bo pojavila v drugi fazi, ne glede na to, ali gre za oborino, če je trdna snov v tekočini ali če se širi v tekočini (Anne Marie Helmenstine, 2016)..
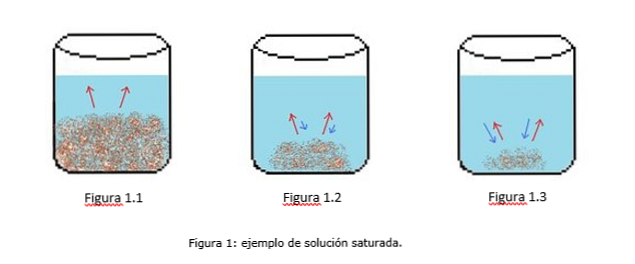
Primer nasičene raztopine je prikazan na sliki 1. Na sliki 1.1, 1.2 in 1.3 je v čaši konstanten volumen vode. Na sliki 1.1 se začne proces nasičenja, kjer se topilo začne raztapljati, kar predstavljajo rdeče puščice.
Na sliki 1.2 je velik del trdne snovi raztopljen, vendar ne popolnoma zaradi postopka rekristalizacije, ki ga predstavljajo modre puščice.
Na sliki 1.3 ostane neraztopljena le majhna količina topila. V tem primeru je stopnja rekristalizacije večja od hitrosti raztapljanja. (tipi zasičenosti, 2014)
Točka največje koncentracije topila v topilu je poznana kot točka nasičenja.
Indeks
- 1 Dejavniki, ki vplivajo na nasičenost
- 1.1 Temperatura
- 1.2 Tlak
- 1.3 Kemijska sestava
- 1.4 Mehanski dejavniki
- 2 Krivulje nasičenosti in topnosti
- 3 Primeri nasičenih raztopin
- 4 Kaj je preveč nasičena raztopina?
- 5 Reference
Dejavniki, ki vplivajo na nasičenost
Količina topila, ki se lahko raztopi v topilu, je odvisna od različnih dejavnikov, med katerimi so najpomembnejši:
Temperatura
Topnost se poveča s temperaturo. V vroči vodi lahko na primer raztopite več soli kot v hladni vodi.
Vendar lahko obstajajo izjeme, npr. Topnost plinov v vodi se z naraščanjem temperature zmanjšuje. V tem primeru molekule topljenca ob segrevanju prejmejo kinetično energijo, kar olajša njihov pobeg.
Pritisk
Povečanje tlaka lahko povzroči raztapljanje raztopine. To se običajno uporablja za raztapljanje plinov v tekočinah.
Kemična sestava
Narava raztopine in topila ter prisotnost drugih kemičnih spojin v raztopini vplivajo na topnost. Na primer, v vodi lahko raztopite večjo količino sladkorja kot sol v vodi. V tem primeru velja, da je sladkor bolj topen.
Etanol v vodi je popolnoma topen med seboj. V tem posebnem primeru bo topilo spojina, ki je v večji količini.
Mehanski dejavniki
V nasprotju s hitrostjo raztapljanja, ki je odvisna predvsem od temperature, je hitrost prekristalizacije odvisna od koncentracije topila na površini kristalne rešetke, ki je prednostna, če je raztopina nepremična..
Zato, mešanje raztopine izogibajte se temu kopičenju, kar bi povečalo raztapljanje (tipi nasičenosti, 2014).
Krivulje nasičenosti in topnosti
Krivulje topnosti so grafična podatkovna zbirka, kjer se primerja količina topila, ki se raztopi v količini topila, pri določeni temperaturi.
Krivulje topnosti se običajno prikažejo za količino raztopine, bodisi trdne ali plinske, v 100 gramih vode (Brian, 2014).
Slika 2 prikazuje krivulje nasičenosti za več raztopin v vodi.

V osi koordinat imate temperaturo v stopinjah Celzija, v osi abscis pa imate koncentracijo raztopine, izražene v gramih raztopine na 100 gramov vode..
Krivulja prikazuje točko nasičenosti pri določeni temperaturi. Območje pod krivuljo kaže, da imate nenasičeno raztopino in zato lahko dodate več raztopljene snovi.
Območje nad krivuljo ima prezasičeno raztopino. (Krivulje topnosti, s.f.)
Če vzamemo na primer natrijev klorid (NaCl), pri 25 stopinjah Celzija, lahko raztopimo približno 35 gramov NaCl v 100 g vode, da dobimo nasičeno raztopino. (Univerza Cambrige, s.f.)
Primeri nasičenih raztopin
Nasičene raztopine je mogoče najti vsakodnevno, ni treba biti v kemijskem laboratoriju. Topilo ni nujno, da je voda. Spodaj so vsakdanji primeri nasičenih rešitev:
-Soda in brezalkoholne pijače so na splošno nasičene z ogljikovim dioksidom v vodi. Zato se ob sproščanju tlaka oblikujejo mehurčki ogljikovega dioksida.
-Zemeljska tla so nasičena z dušikom.
-Kiši lahko dodamo sladkor ali sol, da dobimo nasičeno raztopino.
-Dodajte čokoladni prah mleku, dokler se ne raztopi, da nastane nasičena raztopina.
-Mleko se lahko do te mere nasiči z moko, da se mleku ne dodaja več moke.
-Staljeno maslo je lahko nasičeno s soljo, ko se sol več ne raztopi.
Kaj je preveč nasičena raztopina?
Opredelitev prenasičene raztopine je tista, ki vsebuje več raztopljene snovi, kot bi jo običajno raztopili v topilu. To se ponavadi doseže s povečanjem temperature raztopine.
Rahla sprememba raztopine ali vnos "semena" ali drobnih kristalov raztopine bo prisililo kristalizacijo odvečne raztopine. Če ni točke nukleacije za tvorbo kristalov, lahko odvečna raztopina ostane v raztopini.
Ob previdnem ohlajanju nasičene raztopine se lahko pojavi še ena oblika prenasičenja. Ta sprememba pogojev pomeni, da je koncentracija dejansko večja od točke nasičenosti, raztopina je bila preveč nasičena.
To se lahko uporabi v procesu rekristalizacije za čiščenje kemikalije: raztopi se do točke nasičenja v vročem topilu, potem ko se topilo ohladi in se topnost zmanjša, se odvečna raztopina obori.
Nečistoče, ki so prisotne v veliko nižji koncentraciji, ne nasičijo topila in tako ostanejo raztopljene v tekočini.
Reference
- Anne Marie Helmenstine, P. (2016, 7. julij). Opredelitev in primeri nasičene raztopine. Vzpostavljeno iz about: about.com
- Univerza Cambrige. (s.f.). Krivulje topnosti. Vzpostavljeno iz dynamicscience.com: dynamicscience.com.au.
- Primeri nasičene raztopine. (s.f.). Pridobljeno iz vaše klicne kartice: examples.yourdictionary.com.
- , S. (2014, 4. junij). Nasičene in prezračene raztopine. Vzpostavljeno s socratic.org: socratic.org.
- James, N. (s.f.). Nasičena raztopina: Definicija in primeri. Vzpostavljeno iz študije.com: study.com.
- , B. (2014, 14. oktober). Nasičene in prezračene raztopine. Vzpostavljeno s socratic.org: socratic.org.
- Krivulje topnosti. (s.f.). Vzpostavljeno iz KentChemistry: kentchemistry.com.
- Nasveti nasičenja. (2014, 26. junij). Pridobljeno iz kemije libretex: chem.libretexts.org.


