Struktura amonijevega hidroksida, lastnosti, nomenklatura, uporabe
The amonijev hidroksid je spojina NH molekulske formule4OH ali H5NE proizvaja se z raztapljanjem amoniakovega plina (NH3) v vodi. Zato prejme imena amoniaka ali tekočega amoniaka.
Je brezbarvna tekočina z zelo intenzivnim in ostrim vonjem, ki ni izolacijska. Te lastnosti so neposredno povezane s koncentracijo NH3 raztopimo v vodi; koncentracija, ki dejansko pomeni plin, lahko pokriva velike količine raztopljene v majhni količini vode.
Precej majhen del teh vodnih raztopin je sestavljen iz kationov NH4+ in OH anioni-. Po drugi strani pa lahko v zelo razredčenih raztopinah ali v zamrznjenih trdnih snoveh pri zelo nizkih temperaturah najdemo amoniak v obliki hidratov, kot so: NH3. H2O, 2NH3. H2O in NH32H2O.
Občutno dejstvo je, da so oblaki Jupitra nastali z razredčenimi raztopinami amonijevega hidroksida. Vendar pa vesoljska sonda Galileo ni uspela najti vode v oblaku planeta, kar bi lahko pričakovali, če bi vedeli, da je nastanek amonijevega hidroksida znan; to so kristali NH4OH popolnoma brezvodni.
Amonijev ion (NH4+) se proizvaja v tubularnem lumnu ledvic s povezovanjem amoniaka in vodika, ki ga izločajo tubularne celice ledvic. Podobno se amonij proizvaja v ledvičnih tubularnih celicah v procesu pretvorbe glutamina v glutamat in v zameno pri pretvorbi glutamata v α-ketoglutarat..
Amoniak se industrijsko proizvaja po Haber-Boschevi metodi, v kateri reagirajo plini dušika in vodika; kot katalizatorje uporabimo železov ion, aluminijev oksid in kalijev oksid. Reakcija se izvaja pri visokih tlakih (150 - 300 atmosfer) in visokih temperaturah (400-500 ° C), z donosom 10-20%..
V reakciji nastane amoniak, ki pri oksidaciji proizvaja nitrite in nitrate. Te so bistvene za pridobivanje dušikove kisline in gnojil, kot je amonijev nitrat.
Indeks
- 1 Kemijska struktura
- 1.1 Amoniakalni led
- 2 Fizikalne in kemijske lastnosti
- 2.1 Molekularna formula
- 2.2 Molekularna teža
- 2.3 Videz
- 2.4 Koncentracija
- 2.5 Vonj
- 2.6 Okus
- 2.7 Vrednost praga
- 2.8 Vrelišče
- 2.9 Topnost
- 2.10 Topnost v vodi
- 2.11 Gostota
- 2.12 Gostota hlapov
- 2.13 Parni tlak
- 2.14 Jedko delovanje
- 2,15 pH
- 2.16 Disociacijska konstanta
- 3 Nomenklatura
- 4 Topnost
- 5 Tveganja
- 5.1 Reaktivnost
- 6 Uporabe
- 6.1 V hrani
- 6.2 Terapevtiki
- 6.3 Industrijsko in razno
- 6.4 V kmetijstvu
- 7 Reference
Kemijska struktura
Kot je razvidno iz njegove opredelitve, amonijev hidroksid sestoji iz vodne raztopine plina amoniaka. Zato znotraj tekočine ni definirane druge strukture, kot je naključno razvrščanje ionov NH4+ in OH- solvatirane z vodnimi molekulami.
Amonijevi in hidroksilni ioni so produkt ravnotežja hidrolize amoniaka, zato je običajno, da imajo te raztopine oster vonj:
NH3(g) + H2O (l) <=> NH4+(ac) + OH-(ac)
V skladu s kemijsko enačbo bi visoko znižanje koncentracije vode premaknilo ravnotežje v nastajanje več amoniaka; kar pomeni, da se amonijev hidroksid segreje, se sproščajo pare amonijaka.
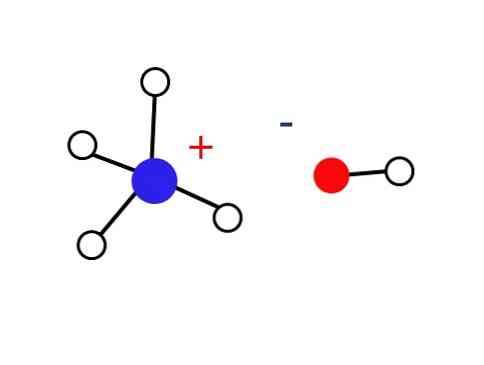
Zato so ioni NH4+ in OH- ne uspejo tvoriti kristala v zemeljskih pogojih, kar ima za posledico, da je trdna podlaga NH4OH ne obstaja.
Ta trdna snov mora biti sestavljena samo iz ionov, ki so v interakciji elektrostatično (kot je prikazano na sliki)..
Amoniakalni led
Toda pri temperaturah pod 0 ° C in obdani z ogromnimi pritiski, kot so tisti, ki prevladujejo v jedrih ledenih lun, amonijak in voda zamrzneta. Pri tem kristalizirajo v trdni zmesi z različnimi stehiometričnimi razmerji in so najpreprostejši NH3. H2O: amoniak monohidrat.
NH3. H2O in NH32H2Ali pa so amoniakalni led, saj je trdna snov iz kristalinične razporeditve vodnih molekul in amoniaka, ki ga vežejo vodikove vezi..
Glede na spremembo T in P, glede na računske študije, ki simulirajo vse fizikalne spremenljivke in njihove učinke na ta led, pride do prehoda NH faze.3H nH2Ali v fazo NH4OH.
Torej, samo v teh ekstremnih pogojih, NH4OH lahko obstaja kot produkt protonacije v ledu med NH3 in H2O:
NH3(s) + H2O (s) <=> NH4OH (s)
Upoštevajte, da so tokrat v nasprotju s hidrolizo amoniaka vpletene vrste v trdni fazi. Amoniakalni led, ki postane slan, ne da bi sprostil amonijak.
Fizikalne in kemijske lastnosti
Molekularna formula
NH4OH ali H5Št
Molekularna teža
35,046 g / mol
Videz
Je brezbarvna tekočina.
Koncentracija
Do približno 30% (za ione NH4+ in OH-).
Vonj
Zelo močna in ostra.
Okus
Acre.
Vrednost praga
34 ppm za nespecifično odkrivanje.
Vrelišče
38 ºC (25%).
Topnost
Obstaja samo v vodni raztopini.
Topnost v vodi
Meša se v neomejenih razmerjih.
Gostota
0,90 g / cm3 pri 25 ° C.
Gostota pare
Glede na zrak, ki se vzame kot enota: 0,6. To pomeni, da je manj gosta od zraka. Vendar je logično, da se navedena vrednost nanaša na amoniak kot plin, ne na njegove vodne raztopine ali na NH4OH.
Parni tlak
2.160 mmHg pri 25 ° C.
Jedko delovanje
Sposoben je raztapljati cink in baker.
pH
11,6 (raztopina 1 N); 11.1 (raztopina 0.1 N) in 10,6 (0,01 N raztopina).
Konstanta disociacije
pKb = 4,767; Kb = 1,71 x 10-5 pri 20 ° C
pKb = 4,751; Kb = 1,774 x 10-5 pri 25 ° C.
Povečanje temperature skoraj neopazno poveča bazičnost amonijevega hidroksida.
Nomenklatura
Katera so skupna in uradna imena, ki jih prejme NH?4OH? Glede na ugotovitve IUPAC se imenuje amonijev hidroksid, ker vsebuje hidroksil anion.
Amonij po obremenitvi +1 je monovalenten, zato se z uporabo nomenklature Stock imenuje: amonijev hidroksid (I).
Čeprav je uporaba amonijevega hidroksida tehnično napačna, ker spojina ni izolirana (vsaj ne na Zemlji, kot je podrobno pojasnjeno v prvem oddelku).
Poleg tega amonijev hidroksid prejme imena amoniakove vode in tekočega amoniaka.
Topnost
NH4OH, ker v kopenskih pogojih ni soli, ni mogoče oceniti, kako topen je v različnih topilih.
Vendar pa bi pričakovali, da bo v vodi zelo topen, saj bi njegova razgradnja sproščala velike količine NH3. Teoretično bi bil to odličen način za shranjevanje in prevoz amoniaka.
V drugih topilih, ki so sposobna sprejeti vodikove vezi, kot so alkoholi in amini, lahko pričakujemo, da bo tudi v njih zelo topen. Tukaj je NH kation4+ je donor vodikovih mostov in OH- deluje tako, kot oboje.
Primeri teh interakcij z metanolom bi bili: H3N+-H-OHCH3 in HO- - HOCH3 (OHCH3 označuje, da kisik prejme vodikovo vez, ne da je metilna skupina vezana na H)..
Tveganja
-Pri stiku z očmi povzroča draženje, ki lahko povzroči poškodbe oči.
-Je jedka. Zato lahko ob stiku s kožo povzroči draženje in pri visokih koncentracijah reagenta povzroči opekline kože. Ponovljeni stik amonijevega hidroksida s kožo lahko povzroči njegovo suhost, srbenje in pordelost (dermatitis)..
-Vdihavanje spreja amonijevega hidroksida lahko povzroči akutno draženje dihalnih poti, za katero je značilno zadušitev, kašljanje ali zasoplost. Dolgotrajna ali ponavljajoča izpostavljenost snovi lahko povzroči ponavljajoče se bronhialne okužbe. Tudi vdihavanje amonijevega hidroksida lahko povzroči draženje pljuč.
-Izpostavljenost visokim koncentracijam amonijevega hidroksida je lahko nujna medicinska pomoč, saj se lahko pojavi kopičenje tekočine v pljučih (pljučni edem)..
-Koncentracija 25 ppm je bila vzeta kot mejna vrednost izpostavljenosti v 8-urni delovni izmeni v okolju, kjer je delavec izpostavljen škodljivemu delovanju amonijevega hidroksida..
Reaktivnost
-Poleg tega o morebitni škodi za zdravje zaradi izpostavljenosti amonijevemu hidroksidu obstajajo drugi previdnostni ukrepi, ki jih je treba upoštevati pri delu s snovjo.
-Amonijev hidroksid lahko reagira s številnimi kovinami, kot so: srebro, baker, svinec in cink. Prav tako reagira s solmi teh kovin, da tvori eksplozivne spojine in sprosti plin vodik; ki je vnetljiva in eksplozivna.
-Lahko burno reagira z močnimi kislinami, na primer: klorovodikovo kislino, žveplovo kislino in dušikovo kislino. Prav tako reagira na enak način z dimetil sulfatom in halogeni.
-Reagira z močnimi bazami, kot so natrijev hidroksid in kalijev hidroksid, ki proizvaja plinasti amoniak. To lahko preverimo, če opazimo ravnotežje v raztopini, v katerem dodamo OH ione- premakne ravnotežje na tvorbo NH3.
-Pri ravnanju z amonijevim hidroksidom se ne smejo uporabljati bakrene in aluminijeve kovine ter druge pocinkane kovine..
Uporabe
V hrani
-Uporablja se kot dodatek v številnih živilih, v katerih deluje kot vzhajalno sredstvo, pH nadzor in sredstvo za končno obdelavo površine hrane..
-Seznam živil, v katerih se uporablja amonijev hidroksid, je obsežen in vključuje pecivo, sire, čokolado, sladkarije in pudinge..
-FDA razvršča amonijev hidroksid kot varno snov za predelavo hrane, pod pogojem, da se upoštevajo uveljavljeni standardi.
-V mesnih izdelkih se uporablja kot protimikrobno sredstvo, saj lahko izloči bakterije, kot je E. coli, in ga zmanjša na nezaznavne vrednosti. Bakterijo najdemo v črevesju goveda, ki se prilagaja kislinskemu okolju. Amonijev hidroksid z uravnavanjem pH zavira rast bakterij.
Terapevtiki
-Amonijev hidroksid ima več terapevtskih uporab, vključno z:
-10% raztopina se uporablja kot stimulans dihalnega refleksa
-Navzven se uporablja na koži za zdravljenje ugrizi in ugrizi žuželk - Deluje na prebavni sistem kot antacid in proti vlagi, kar pomeni, da pomaga pri odstranjevanju plinov.
Poleg tega se uporablja kot topikalno sredstvo za akutno in kronično mišično-skeletno bolečino. Kot posledica rubefacientnega delovanja amonijevega hidroksida obstaja lokalno povečanje pretoka krvi, rdečina in draženje..
Industrijsko in razno
-Deluje pri zmanjševanju NOx (visoko reaktivni plini, kot so dušikov oksid (NO) in dušikov dioksid (NO2)) za emisije dimnikov in zmanjšanje emisij NOx v emisije dimnikov.
-Uporablja se kot sredstvo za mehčanje; Aditiv barv in za obdelavo površin.
-Povečuje poroznost las, tako da imajo pigmenti madežev večjo penetracijo, kar omogoča boljši zaključek..
-Amonijev hidroksid se uporablja kot protimikrobno sredstvo pri obdelavi odpadne vode. Poleg tega posega v sintezo kloramina. Ta snov izpolnjuje funkcijo, podobno kloru, pri čiščenju vode v bazenu, ki ima prednost, da je manj toksična.
-Uporablja se kot inhibitor korozije v procesu rafiniranja olja.
-Uporablja se kot čistilno sredstvo v različnih industrijskih in komercialnih proizvodih, uporablja se na več površinah, vključno z: nerjavnim jeklom, porcelanom, steklom in pečico..
-Poleg tega se uporablja v proizvodnji detergentov, mil, farmacevtskih izdelkov in črnil.
V kmetijstvu
Čeprav ni neposredno uporabljen kot gnojilo, amonijev hidroksid izpolnjuje to funkcijo. Amonijak se proizvaja iz atmosferskega dušika po metodi Haber-Bosch in se hladi pod njegovim vreliščem (-33 ° C) na mesta njegove uporabe..
Tlačni amonijak se v obliki pare vbrizga v zemljo, kjer takoj reagira z edafsko vodo in preide v amonijevo obliko (NH).4+), ki se zadrži v mestih za izmenjavo kationov. Poleg tega se proizvaja amonijev hidroksid. Te spojine so vir dušika.
Skupaj s fosforjem in kalijem dušik predstavlja triado glavnih hranil rastlin, ki so bistvene za njeno rast.
Reference
- Ganong, W. F. (2002) Medicinska fiziologija. 19. izdaja. Uredniški sodobni priročnik.
- A. D. Fortes, J. P. Brodholt, I. G. Wood in L. Vocadlo. (2001). Ab initio simulacija amoniaka monohidrata (NH3. H2O) in amonijev hidroksid (NH4OH). Ameriški inštitut za fiziko. J. Chem., Phys., 115, 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6. februar 2017). Dejstva o amonijevem hidroksidu. Vzpostavljeno iz: thoughtco.com
- Skupina Pochteca. (2015). Amonijev hidroksid. pochteca.com.mx
- Zdravje NJ (s.f.). Informacije o nevarnih snoveh: amonijev hidroksid. [PDF] Vzpostavljeno iz: nj.gov
- Učenec kemije. (2018). Amonijev hidroksid. Vzpostavljeno iz: chemistrylearner.com
- PubChem. (2018). Amonijev hidroksid. Vzpostavljeno iz: pubchem.ncbi.nlm.nih.gov


