Tipi in primeri molekularne geometrije
The geometrijo molekul o molekularne strukture je prostorska porazdelitev atomov okoli osrednjega atoma. Atomi predstavljajo regije, kjer je visoka elektronska gostota, in se zato štejejo za elektronske skupine, ne glede na to, kakšne so povezave (enojne, dvojne ali trojne)..
Ta koncept je nastal iz kombinacije in eksperimentalnih podatkov dveh teorij: valenčne vezi (TEV) in odbijanja elektronskih parov valenčne lupine (VSPR). Medtem ko prva določa povezave in njihove kote, druga vzpostavi geometrijo in zato molekularno strukturo.

Kakšne geometrijske oblike so molekule, ki so sposobne sprejeti? Dve prejšnji teoriji zagotavljata odgovore. V skladu z VSEPR morajo biti atomi in pari prostih elektronov razporejeni v prostoru tako, da je elektrostatično odbijanje med njimi čim manjše..
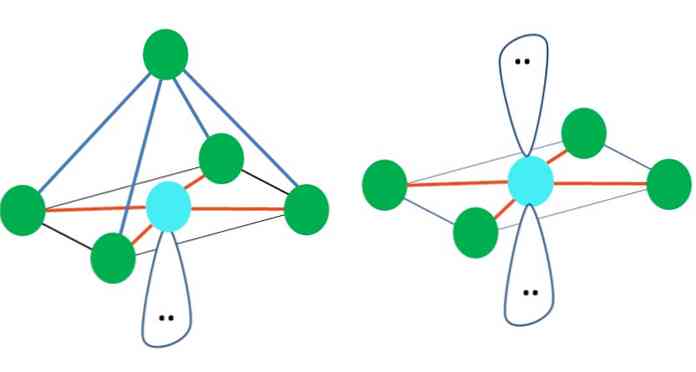
Torej geometrijske oblike niso poljubne, ampak poiščite najbolj stabilno obliko. Na primer, v zgornji sliki je na levi viden trikotnik, na desni pa oktaeder. Zelene pike predstavljajo atome, oranžne črte pa povezave.
V trikotniku so tri zelene točke usmerjene v razdalji 120 °. Ta kot, ki je enak tistemu vezi, omogoča, da se atomi čim manj odbijajo. Zato bo molekula s centralnim atomom, vezanim na tri druge, sprejela trigonsko geometrijo.
Vendar pa VSCR napoveduje, da bo prost par elektronov v osrednjem atomu izkrivil geometrijo. V primeru trigonske ravnine bo ta par potisnil tri zelene točke, kar bo povzročilo geometrijo trigonske piramide.
Enako se lahko zgodi tudi z oktaedrom slike. V njem so vsi atomi ločeni na najbolj stabilen možni način.
Indeks
- 1 Kako poznati vnaprej molekularno geometrijo atoma X?
- 2 Vrste
- 2.1 Linearna
- 2.2 Kotni
- 2.3
- 2.4 Trigonalna bipiramida
- 2,5
- 2.6 Druge geometrije molekul
- 3 Primeri
- 3.1 Linearna geometrija
- 3.2 Kotna geometrija
- 3.3 Trigonski načrt
- 3.4
- 3.5 Trigonska piramida
- 3.6 trigonska bipiramida
- 3.7 Nihanje
- 3.8 Oblika T
- 3.9
- 4 Reference
Kako poznati vnaprej molekularno geometrijo atoma X?
Za to je potrebno upoštevati tudi pare prostih elektronov kot elektronske skupine. Ti, skupaj z atomi, bodo določili, kaj je znano kot elektronska geometrija, ki je neločljiv spremljevalec molekularne geometrije.
Iz elektronske geometrije in po odkritju Lewisove strukture parov prostih elektronov lahko ugotovimo, kakšna bo molekularna geometrija. Vsota vseh geometrij molekul bo zagotovila oris globalne strukture.
Vrste
Kot je razvidno iz glavne slike, je molekularna geometrija odvisna od tega, koliko atomov obkroža osrednji atom. Vendar, če je par elektronov prisoten brez delitve, bo spremenil geometrijo, ker zavzema veliko prostornino. Zato ima sterični učinek.
Glede na to lahko geometrija predstavi vrsto značilnih oblik za mnoge molekule. In tu se pojavljajo različne vrste molekularne geometrije ali molekularne strukture.
Kdaj je geometrija enaka strukturi? Obe označujeta isto le v primerih, ko struktura nima več kot en tip geometrije; v nasprotnem primeru je treba upoštevati vse sedanje vrste in strukturo dati globalno ime (linearno, razvejano, globularno, plosko itd.).
Geometrije so še posebej uporabne za razlago strukture trdne snovi iz njenih strukturnih enot.
Linearna
Vse kovalentne vezi so usmerjene, zato je povezava A-B linearna. Toda, ali bo molekula AB linearna?2? Če da, je geometrija preprosto predstavljena kot: B-A-B. Dva atoma B sta ločena s kotom 180 °, glede na TEV pa mora A imeti hibridne orbitale.
Kotna
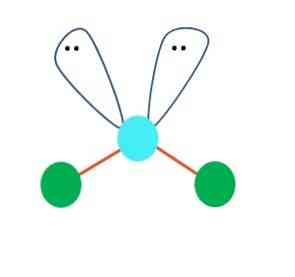
Na prvi stopnji lahko predpostavimo linearno geometrijo molekule AB2; vendar je bistveno, da se sestavi Lewisa, preden se doseže sklep. Z risbo strukture Lewisa lahko določimo število parov elektronov, ne da bi delili (:) na atomu A.
Ko je tako, na vrhu elektronskih parov potisnejo dva atoma B navzdol in spremenita svoj kot. Posledično postane linearna molekula B-A-B postala V, bumerang ali kotna geometrija (zgornja slika)
Molekula vode, H-O-H, je idealen primer za to vrsto geometrije. V atomu kisika obstajata dva para elektronov brez delitve, ki sta usmerjena pod približnim kotom 109 °.
Zakaj ta kot? Ker je elektronska geometrija tetraedarska, ki ima štiri tocke: dve za atome H in dve za elektrone. Na zgornji sliki opazite, da zelene pike in dva "režnja z očmi" v središču narišeta tetraeder z modrikasto točko na sredini..
Če O ne bi imel prostih elektronskih parov, bi voda tvorila linearno molekulo, njena polarnost bi se zmanjšala, oceani, morja, jezera itd. Verjetno ne bi obstajali, kot so znani..
Tetraedarska
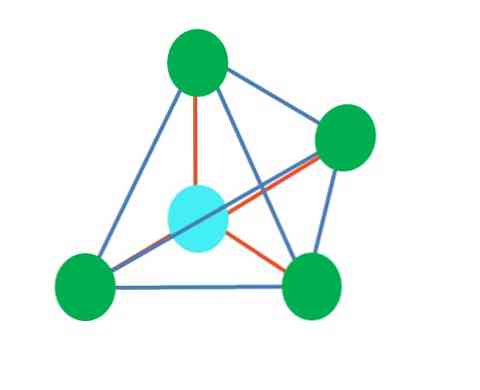
Zgornja slika predstavlja tetraedrsko geometrijo. Za vodno molekulo je njena elektronska geometrija tetraedarska, toda z odstranitvijo parov brez elektrona lahko opazimo, da se transformira v kotno geometrijo. To je mogoče opaziti tudi z odpravo dveh zelenih pik; preostala dva bosta narisala V z modro piko.
Kaj če bi namesto dveh parov prostih elektronov obstajala le ena? Potem bi bila trigonska ravnina (glavna slika). Vendar se z izločitvijo elektronske skupine sterični učinek, ki ga povzroči par prostih elektronov, ne izogne. Zato izkrivlja trigonsko ravnino do trikotne bazne piramide:

Čeprav je trigonska in tetraedarska piramidna molekularna geometrija drugačna, je elektronska geometrija enaka: tetraedarska. Torej trigonska piramida se ne šteje kot elektronska geometrija?
Odgovor je ne, saj je produkt popačenja, ki ga povzroča "lobe z očmi" in njegov sterični učinek, ta geometrija pa ne upošteva poznejših izkrivljanj..
Zato je vedno pomembno določiti elektronsko geometrijo s pomočjo Lewisovih struktur, preden določimo geometrijo molekul. Molekula amoniaka, NH3, je primer trigonalne piramidne molekularne geometrije, toda z tetraedrsko elektronsko geometrijo.
Trigonal Bipyramid
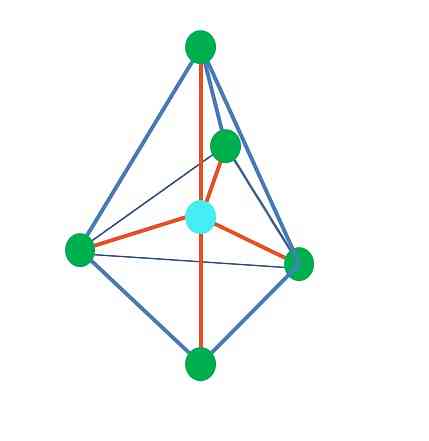
Do sedaj, z izjemo linearne geometrije, v tetraedrični, angularni in trigonski piramidi njeni osrednji atomi sp hibridizirajo3, v skladu s TEV. To pomeni, da če so vaši koti povezave določeni eksperimentalno, morajo biti okoli 109 °.
Iz trigonalne dipiramidne geometrije obstaja pet elektronskih skupin okoli osrednjega atoma. Na zgornji sliki lahko vidite pet zelenih točk; tri v trikotni podlagi in dve v aksialnih položajih, ki sta zgornji in spodnji vrh piramide.
Kakšno hibridizacijo ima modra pika? Potrebuje pet hibridnih orbitalov, da oblikuje preproste vezi (oranžno). To se doseže s petimi sp orbitali3d (produkt mešanice orbitalne s, tri p in a d).
Ko razmišljamo o petih elektronskih skupinah, je geometrija tista, ki je že izpostavljena, vendar ima pare elektronov brez delitve, ta pa spet trpi izkrivljanja, ki ustvarjajo druge geometrije. Prav tako se pojavi naslednje vprašanje: ali lahko ti pari zavzamejo katerokoli mesto v piramidi? To so: aksialna ali ekvatorialna.
Aksialni in ekvatorialni položaji
Zelene točke, ki sestavljajo trikotno osnovo, so v ekvatorialnih položajih, medtem ko sta dve na zgornjem in spodnjem koncu, v aksialnih položajih. Kje bo, po možnosti, par elektronov brez delitve lociran? V tem položaju, ki zmanjšuje elektrostatično odbojnost in sterični učinek.
V aksialnem položaju bi par elektronov "pritisnil" pravokotno (90 °) na trikotno osnovo, če bi bil v ekvatorialnem položaju, bi preostale dve elektronski skupini podstavka narazili 120 ° in pritisnili oba konca pri 90 ° (namesto tri, kot pri bazi).
Zato bo osrednji atom usmeril svoje pare brez elektrona v ekvatorialne položaje, da bi ustvaril bolj stabilne molekularne geometrije.
Oscilacijska in T oblika
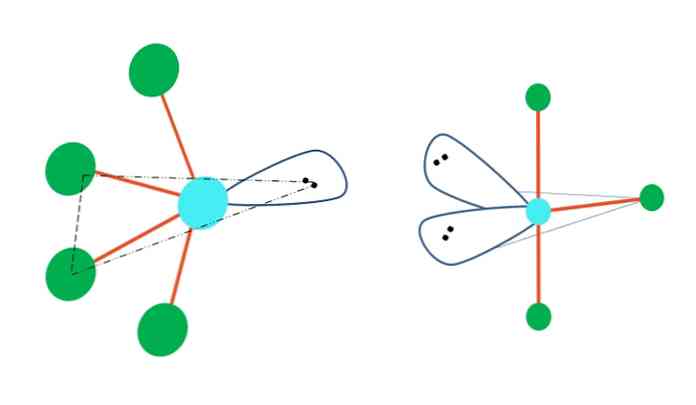
Če bi geometrijo trigonskih bipiramidov zamenjali z enim ali več atomi brez parov brez elektronov, bi imeli tudi različne geometrije molekul..
Levo od zgornje slike se geometrija spremeni v oscilacijsko obliko. V njej prosti par elektronov potisne preostale štiri atome v isto smer, pri čemer zložijo svoje povezave na levo. Upoštevajte, da ta par in dva atoma ležita v isti trikotni ravnini prvotne dipiramide.
Desno od slike je geometrija v obliki črke T. Ta molekularna geometrija je posledica zamenjave dveh atomov za dva para elektronov, kar povzroči, da so preostali trije atomi poravnani v isti ravnini, ki črpa točno eno črko. T.
Torej, za molekulo tipa AB5, sprejema trigonalno bipiramidno geometrijo. Vendar pa AB4, z isto elektronsko geometrijo bo sprejel oscilacijsko geometrijo; in AB3, geometrijo v obliki črke T. V vseh A bo imela (na splošno) sp hibridizacijo3d.
Za določitev geometrije molekul je potrebno narisati Lewisovo strukturo in s tem njeno elektronsko geometrijo. Če je to trigonalna bipiramida, se pari brez elektrona zavržejo, ne pa tudi njihovi sterični učinki na ostale atome. Tako je mogoče popolnoma razlikovati med tremi možnimi geometrijami molekul.
Oktaedarska
Desno od glavne slike je predstavljena oktaedarska geometrija molekul. Ta vrsta geometrije ustreza AB spojinam6. AB4 tvorijo kvadratno osnovo, preostala dva B pa se postavljata v aksialnih položajih. Tako nastane več enakostraničnih trikotnikov, ki so obrazi oktaedra.
Tudi tu lahko (kot pri vseh elektronskih geometrijah) obstajajo parovi prostih elektronov, zato iz tega izhajajo druge geometrije molekul. Na primer, AB5 z oktaedrično elektronsko geometrijo sestavlja piramida s kvadratno osnovo in AB4 kvadratne ravnine:
Pri oktaedrični elektronski geometriji sta ti dve geometriji molekul najstabilnejši v smislu elektrostatičnega odbijanja. V kvadratni ravnini sta dva elektronska para med seboj oddaljena 180 °.
Kaj je hibridizacija za atom A v teh geometrijah (ali strukturah, če je edina)? TEV ponovno ugotavlja, da je sp3d2, šest hibridnih orbitalov, ki omogočajo A, da usmeri elektronske skupine v tockih oktaedra.
Druge geometrije molekul
S spremembo doslej omenjenih piramidnih baz lahko dobimo nekaj bolj kompleksnih molekularnih geometrij. Na primer, pentagonalna bipiramida temelji na pentagonu in spojine, ki jo tvorijo, imajo splošno formulo AB.7.
Tako kot druge molekularne geometrije, bo zamenjava atomov B z elektroni brez parov izkrivila geometrijo drugih oblik.
Tudi spojine AB8 lahko sprejmejo geometrije, kot je kvadratno antiprizem. Nekatere geometrije so lahko zelo zapletene, zlasti za AB formule7 naprej (do AB12).
Primeri
Nato bomo navedli vrsto spojin za vsako od glavnih geometrij molekul. Kot vajo lahko narišete Lewisove strukture za vse primere in potrdite, da boste glede na elektronsko geometrijo dobili molekularne geometrije, kot so navedene spodaj..
Linearna geometrija
-Etilen, H2C≡CH2
-Berilijev klorid, BeCl2 (Cl-Be-Cl)
-Ogljikov dioksid, CO2 (O = C = O)
-Dušik, N2 (N≡N)
-Živosrebrov dibromid, HgBr2 (Br-Hg-Br)
-Anion trijodid, I3- (I-I-I)
-Vodikov cianid, HCN (H-N≡C)
Njegovi koti morajo biti 180 °, zato imajo sp hibridizacijo.
Kotna geometrija
-Voda
-Žveplov dioksid, SO2
-Dušikov dioksid, št2
-Ozon, O3
-Anion amiduro, NH2-
Trigonska ravnina
-Brom trifluorid, BF3
-Aluminijev triklorid, AlCl3
-Nitratni anion, NO3-
-Anion karbonat, CO32-
Tetraedarska
-Metan, CH4
-Ogljikov tetraklorid, CCl4
-Kation amonij, NH4+
-Anion sulfat, SO42-
Trigonska piramida
-Amoniak, NH3
-Kationski hidronium, H3O+
Trigonal Bipyramid
-Fosforjev pentafluorid, PF5
-Antimonov pentaklorid, SbF5
Nihanje
Žveplov tetrafluorid, SF4
Oblika T
-Jodov triklorid, ICl3
-Klorid trifluorid, ClF3 (obe spojini sta znani kot interhalogeni)
Oktaedarska
-Žveplov heksafluorid, SF6
-Selen heksafluorid, SeF6
-Heksafluorofosfat, PF6-
Da bi dosegli vrhunec, je molekularna geometrija tisto, kar pojasnjuje opazovanja kemijskih ali fizikalnih lastnosti snovi. Vendar pa je usmerjen glede na elektronsko geometrijo, tako da mora biti ta vedno določena pred prvim.
Reference
- Whitten, Davis, Peck & Stanley. Kemija (8. izd.). CENGAGE Learning, str. 194-198.
- Shiver & Atkins. (2008). Anorganska kemija (Četrta izdaja., Str. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Molekularna geometrija in teorija VSEPR. Vzpostavljeno iz: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Uvod v molekularno geometrijo. Vzpostavljeno iz: chemistry.elmhurst.edu
- Kemija LibreTexts. (8. september 2016). Geometrija molekul. Vzpostavljeno iz: chem.libretexts.org


