Kalcijev fosfat (Ca3 (PO4) 2) struktura, lastnosti, tvorba in uporaba
The kalcijev fosfat je anorganska in terciarna sol, katere kemična formula je Ca3(PO4)2. Formula navaja, da je sestava te soli 3: 2 za kalcij oziroma fosfat. To je mogoče videti neposredno na spodnji sliki, kjer je prikazan Ca-kation2+ in anion PO43-. Za vsake tri Ca2+ Obstajata dve PO43- interakcijo z njimi.
Po drugi strani se kalcijev fosfat nanaša na vrsto soli, ki se razlikujejo glede na razmerje Ca / P, kakor tudi stopnjo hidracije in pH. Pravzaprav obstaja veliko vrst kalcijevih fosfatov, ki obstajajo in jih je mogoče sintetizirati. Po dobesednem upoštevanju nomenklature pa se kalcijev fosfat nanaša samo na omenjeni trikalcijev.

Vsi kalcijevi fosfati, vključno s Ca3(PO4)2, So trdno bele barve z rahlo sivkastimi toni. Lahko so zrnate, fine, kristalinične in imajo velikosti delcev okoli mikrometra; pripravljeni so bili tudi nanodelci teh fosfatov, s katerimi so zasnovani biokompatibilni materiali za kosti.
Ta biokompatibilnost je posledica dejstva, da so te soli najdene v zobih in na kratko v kostnih tkivih sesalcev. Na primer, hidroksiapatit je kristaliničen kalcijev fosfat, ki nato interagira z amorfno fazo iste soli..
To pomeni, da obstajajo amorfni in kristalni kalcijevi fosfati. Zaradi tega raznolikost in številne možnosti niso presenetljive, če sintetiziramo materiale na osnovi kalcijevih fosfatov; materiali, v katerih so raziskovalci bolj zainteresirani vsak dan po svetu, da se osredotočijo na obnovo kosti.
Indeks
- 1 Struktura kalcijevega fosfata
- 1.1 Amorfni kalcijev fosfat
- 1.2 Preostali del družine
- 2 Fizikalne in kemijske lastnosti
- 2.1 Imena
- 2.2 Molekularna teža
- 2.3 Fizični opis
- 2.4 Okus
- 2.5 Tališče
- 2.6 Topnost
- 2.7 Gostota
- 2.8 Refrakcijski indeks
- 2.9 Standardna entalpija vadbe
- 2.10 Temperatura skladiščenja
- 2,11 pH
- 3 Usposabljanje
- 3.1 Kalcijev nitrat in amonijev hidrogen fosfat
- 3.2 Kalcijev hidroksid in fosforjeva kislina
- 4 Uporabe
- 4.1 V kostnem tkivu
- 4.2 Biokeramični cementi
- 4.3 Zdravniki
- 4.4 Drugo
- 5 Reference
Struktura kalcijevega fosfata
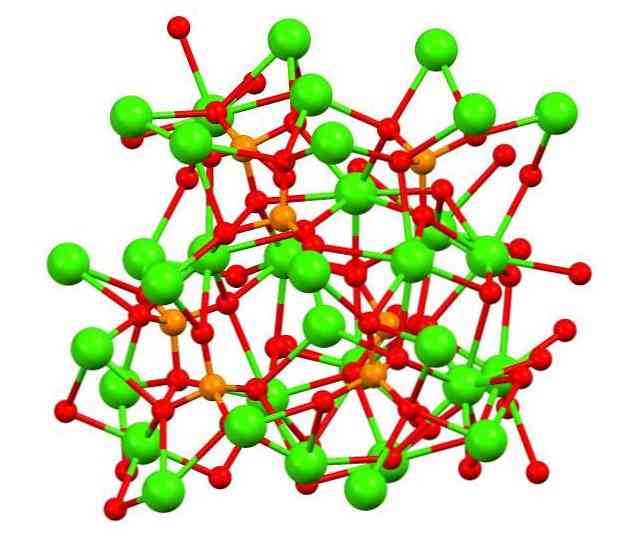
Zgornja slika prikazuje strukturo tribazičnega kalikovega fosfata v čudnem mineralu whitlockite, ki lahko vsebuje magnezij in železo kot nečistoče..
Čeprav se na prvi pogled zdi zapleteno, je treba pojasniti, da model predvideva kovalentne interakcije med kisikovimi atomi fosfatov in kovinskimi centri kalcija..
Predstavitev je veljavna, vendar so interakcije elektrostatične; to so kationi Ca2+ privlačijo PO anioni43- (Ca2+- O-PO33-). S tem v mislih je razumljivo, zakaj so na sliki kalcij (zelene krogle) obdani z negativno nabitimi atomi kisika (rdeče sfere)..
Ko je toliko ionov, ne ostane vidna simetrična razporeditev ali vzorec. Ca3(PO4)2 Sprejema se pri nizkih temperaturah (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, za kratico v angleščini).
Po drugi strani pa se pri visokih temperaturah pretvori v polimorf α-Ca3(PO4)2 (α-TCP), katere enota celice ustreza monoklinskemu kristalnemu sistemu. Pri še višjih temperaturah lahko nastane tudi polimorf α'-Ca3(PO4)2, ki je iz šesterokotne kristalne strukture.
Amorfni kalcijev fosfat
Kristalne strukture so bile omenjene za kalcijev fosfat, ki se pričakuje od soli. Vendar pa je sposoben razstaviti neurejene in asimetrične strukture, ki so bolj povezane s tipom "kalcijevega fosfatnega stekla" kot s kristali v strogem pomenu njegove definicije..
Ko se to zgodi, je rečeno, da ima kalcijev fosfat amorfno strukturo (ACP, amorfni kalcijev fosfat). Več avtorjev opozarja na to vrsto strukture, ki je odgovorna za biološke lastnosti Ca3(PO4)2 v kostnih tkivih, možno je njegovo popravilo in biomimetizacija.
Skozi pojasnitev njene strukture z jedrsko magnetno resonanco (NMR) je bila ugotovljena prisotnost OH ionov- in HPO42- v državah AKP. Ti ioni nastanejo s hidrolizo enega od fosfatov:
PO43- + H2O <=> HPO42- + OH-
Posledica tega je, da prava struktura ACP postane bolj kompleksna, katere sestava njenih ionov je predstavljena s formulo: Ca9(PO4)6-x(HPO4)x(OH)x. "X" označuje stopnjo hidracije, ker če je x = 1, potem je formula taka: Ca9(PO4)5(HPO4) (OH).
Različne strukture, ki so lahko PCA odvisne od Ca / P molarnih razmerij; to pomeni, relativne količine kalcija in fosfata, ki spreminjajo vse nastale sestave.
Preostali del družine
Kalcijevi fosfati so v resnici družina anorganskih spojin, ki lahko interakcijo z organsko matrico.
Drugi fosfati se pridobijo "preprosto" s spremembo anionov, ki spremljajo kalcij (PO43-, HPO42-, H2PO4-, OH-), pa tudi vrsto nečistoč v trdni snovi. Tako lahko do enajst kalcijevih fosfatov ali več, vsaka s svojo strukturo in lastnostmi, lahko izvira naravno ali umetno..
Spodaj so navedeni nekateri fosfati in njihove strukture in kemijske formule:
-Vodikov kalcijev fosfat dihidrat, CaHPO42H2O: monoklinična.
-Kalcijev dihidrogenfosfat monohidrat, Ca (H)2PO4)2. H2O: triclinic.
-Brezvodni diacidni fosfat, Ca (H) \ t2PO4)2: triclinic.
-Kloridni fosfat (OCP), Ca8H2(PO4)6: triclinic Je predhodnik v sintezi hidroksiapatita.
-Hidroksiapatit, Ca5(PO4)3OH: šesterokotna.
Fizikalne in kemijske lastnosti
Imena
-Kalcijev fosfat
-Trikalcijev fosfat
-Trikalcijev difosfat
Molekularna teža
310,74 g / mol.
Fizični opis
Bela trdna snov brez vonja.
Okus
Brez okusa.
Tališče
1670 ºK (1391 ºC).
Topnost
-Praktično netopen v vodi.
-Netopen v etanolu.
-Topen v razredčeni klorovodikovi kislini in dušikovi kislini.
Gostota
3,14 g / cm3.
Indeks refrakcije
1,629
Standardna entalpija treninga
4126 kcal / mol.
Temperatura skladiščenja
2-8 ° C.
pH
6-8 v vodni suspenziji 50 g / L kalcijevega fosfata.
Usposabljanje
Kalcijev nitrat in vodikov amonijev fosfat
Obstajajo številne metode za proizvodnjo ali tvorbo kalcijevega fosfata. Ena od njih je mešanica dveh soli, Ca (NO).3)24H2O in (NH4)2HPO4, predhodno raztopimo v absolutnem alkoholu oziroma v vodi. Ena sol zagotavlja kalcij, drugi pa fosfat.
Iz te zmesi se ACP obori, ki se nato segreje v peči pri 800 ° C in 2 uri. Kot rezultat tega postopka dobimo β-Ca3(PO4)2. Z natančnim nadzorom temperatur, agitacije in časov stika se lahko pojavi nastanek nanokristalov.
Za tvorbo polimorfa α-Ca3(PO4)2 fosfat je treba segrevati nad 1000 ° C. To segrevanje izvedemo v prisotnosti drugih kovinskih ionov, ki stabilizirajo ta polimorf dovolj, da ga lahko uporabimo pri sobni temperaturi; to pomeni, da ostaja v stabilnem meta stanju.
Kalcijev hidroksid in fosforjeva kislina
Kalcijev fosfat lahko nastane tudi z mešanjem raztopin kalcijevega hidroksida in fosforne kisline, pri čemer pride do nevtralizacije kislinske baze. Po pol dneva zorenja v matičnih lužnicah in njihove pravilne filtracije, pranja, sušenja in sejanja dobimo granulirani prašek amorfnega fosfata..
Ta reakcija ACP je produkt visokih temperatur, ki se spreminja po naslednjih kemijskih enačbah:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(P2O7)0,5(PO4)5(OH) + H2O (pri T = 446,60 ° C)
2Ca9(P2O7)0,5(PO4)5(OH) => 3Ca3(PO4)2 + 0,5H2O (pri T = 748,56 ° C)
Na ta način dobimo β-Ca3(PO4)2, najbolj pogost in stabilen polimorf.
Uporabe
V kostnem tkivu
Ca3(PO4)2 Je glavna anorganska sestavina kostnega pepela. Je sestavni del presadkov za kostne nadomestke, kar se pojasni z njegovo kemično podobnostjo z minerali, ki so prisotni v kosti.
Biomateriali s kalcijevim fosfatom se uporabljajo za odpravljanje napak v kosteh in premazu kovinskih protez titana. Na njih se odlaga kalcijev fosfat, ki ga izolira od okolja in upočasni proces titracije.
Kalcijevi fosfati, vključno s Ca3(PO4)2, Uporabljajo se za proizvodnjo keramičnih materialov. Ti materiali so biokompatibilni in se trenutno uporabljajo za obnovitev izgube alveolarne kosti, ki je posledica parodontalne bolezni, endodontskih okužb in drugih bolezni..
Vendar jih je treba uporabljati samo za pospeševanje periapikalnega popravila kosti na območjih, kjer ni kronične bakterijske okužbe.
Kalcijev fosfat se lahko uporablja pri odpravljanju okvar kosti, kadar ni mogoče uporabiti avtogenega kostnega presadka. Možno ga je uporabiti samostojno ali v kombinaciji z biorazgradljivim in resorbirajočim polimerom, kot je poliglikolna kislina.
Biokeramični cementi
Kalcijev fosfatni cement (CPC) je še en biokeramik, ki se uporablja pri obnovi kostnega tkiva. Narejen je z mešanjem praška različnih vrst kalcijevih fosfatov z vodo, pri čemer nastane pasta. Pasta se lahko vbrizga ali prilagodi kostnemu defektu ali votlini.
Cementi so oblikovani, postopoma se resorbirajo in nadomestijo z novo nastalo kostjo.
Zdravniki
-Ca3(PO4)2 Je bazična sol, zato se uporablja kot antacid za nevtralizacijo odvečne želodčne kisline in povečanje pH. V zobni pasti zagotavlja vir kalcija in fosfata za lažji proces remineralizacije zob in hemostaze kosti..
-Uporablja se tudi kot prehransko dopolnilo, čeprav je najcenejši način za zamenjavo kalcija uporaba karbonata in citrata..
-Kalcijev fosfat se lahko uporablja pri zdravljenju tetanije, latentne hipokalcemije in vzdrževalne terapije. Poleg tega je koristen pri dodajanju kalcija med nosečnostjo in dojenjem.
-Uporablja se za zdravljenje kontaminacije z radioaktivnimi izotopi radio (Ra-226) in stroncijev (Sr-90). Kalcijev fosfat blokira absorpcijo radioaktivnih izotopov v prebavnem traktu in tako omejuje škodo, ki jo povzročajo.
Drugi
-Kalcijev fosfat se uporablja kot krma za ptice. Poleg tega se uporablja v zobnih pastah za nadzor zobnega kamna.
-Uporablja se kot sredstvo proti strjevanju, na primer za preprečevanje stiskanja kuhinjske soli.
-Deluje kot belilo za moko. Medtem ko v prašičji masti prašič prepreči neželeno obarvanje in izboljša stanje cvrtja.
Reference
- Tung M.S. (1998) Kalcijevi fosfati: struktura, sestava, topnost in stabilnost. V: Amjad Z. (eds) Kalcijevi fosfati v bioloških in industrijskih sistemih. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu in Honglian Dai. (2018). "Sinteza, karakterizacija nano-β-trikalcijevega fosfata in inhibicija celic hepatocelularnega karcinoma," Journal of Nanomaterials, vol. 2018, ID članka 7083416, 7 strani, 2018.
- Kombiji, Kristus in Rey, Christian. (2010). Amorfni kalcijevi fosfati: sinteza, lastnosti in uporaba v biomaterialih. Acta Biomaterialia, vol. 6 (n ° 9). str. 3362-3378. ISSN 1742-7061
- Wikipedija. (2019). Trikalcijev fosfat. Vzpostavljeno iz: en.wikipedia.org
- Abida et al. (2017). Trikalcijev fosfat v prahu: sposobnost priprave, karakterizacije in kompaktiranja. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Kalcijev fosfat. Vzpostavljeno iz: pubchem.ncbi.nlm.nih.gov
- Elsevier (2019). Kalcijev fosfat. Science Direct. Vzpostavljeno iz: sciencedirect.com


