Lastnosti natrijevega dikromata, proizvodnja, nevarnosti in uporabe
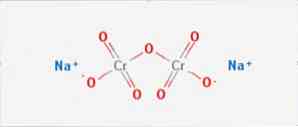
The natrijevega dikromata je anorganska spojina s formulo Na2Cr207. Je ena od mnogih šestvalentnih kromovih spojin (Cr VI). Njegova struktura je prikazana na sliki 1, čeprav se sol običajno obdeluje v njeni dihidrirani obliki, katere formula bi bila Na2Cr2O7 · H2O.
Ima dve ionski vezi med natrijevima molekulama in negativno nabitih kisikom. Kromova ruda se ekstrahira iz natrijevega dikromata. Letno se proizvedejo milijoni kilogramov natrijevega dikromata.
Kitajska je največji proizvajalec natrijevega dikromata, vendar imajo kitajske kemične tovarne razmeroma nizko proizvodnjo, manj kot 50.000 ton na leto, v primerjavi s tovarno v Kazahstanu, ki proizvede več kot 100.000 ton na leto..
Obrati v Rusiji, ZDA in Združenem kraljestvu imajo vmesno proizvodnjo med 50.000 in 100.000 ton letno (Kogel, 2006).
Glede reaktivnosti in videza ima natrijev dikromat podobne lastnosti kot kalijev dikromat, vendar je natrijeva sol bolj topna v vodi in ima ekvivalent mase, manjšo od kalijeve soli..
Natrijev dikromat proizvaja strupene kromove pare pri segrevanju. Je močno oksidacijsko sredstvo in je zelo jedko.
To spojino lahko najdemo v virih pitne vode, onesnaženih z različnimi industrijskimi postopki, kot so tehnike galvanizacije ali galvanizacije, strojenje usnja in proizvodnja tekstila.
Indeks
- 1 Fizikalne in kemijske lastnosti
- 2 Metode proizvodnje
- 3 Reaktivnost in nevarnosti
- 4 Uporaba in aplikacije
- 5 Biokemija
- 6 Reference
Fizikalne in kemijske lastnosti
Natrijev dikromat je sestavljen iz kristalov z rdečkasto oranžno monoklinsko strukturo v brezvodni in brez vonja obliki. Njegova molekulska masa je 261,97 g / mol v svoji brezvodni obliki in 298,00 g / mol v svoji dihidrirani obliki..
Ima tališče 356,7 stopinj Celzija, vrelišče pa 400 stopinj Celzija, v katerem se razgradi. Ima gostoto 2,52 g / ml.

Slika 2 prikazuje videz natrijevega dikromata. Njegova topnost v vodi je 187 g na 100 gramov pri 25 stopinjah Celzija in njegova topnost v etanolu je 513,2 gramov na liter pri 19,4 stopinjah Celzija (Nacionalni center za biotehnološke informacije, s.f.).
Šteje se za stabilno spojino, če je shranjena v priporočenih pogojih in ni vnetljiva. Ker je močno oksidacijsko sredstvo, je jedko in v raztopini je kislina, ki ima sposobnost znižati pH na 4 v raztopini 1% w / v..
Metode proizvodnje
Natrijev kromat se lahko pretvori v dikromat z neprekinjenim postopkom, ki obdeluje z žveplovo kislino, ogljikovim dioksidom ali kombinacijo teh dveh.
Uparjanje natrijeve dikromatne tekočine povzroči obarjanje natrijevega sulfata in / ali natrijevega bikarbonata in te spojine odstranimo pred končno kristalizacijo natrijevega dikromata..
Natrijev dikromat se lahko izvede v treh korakih:
- Alkalno praženje pogojev oksidacije kromita
- Izpiranje. Ekstrakcija topne snovi iz zmesi z delovanjem tekočega topila
- Pretvorba natrijevega monokromata v natrijev dikromat s pomočjo kisline.
Brezvodni natrijev dikromat lahko pripravimo s taljenjem natrijevega dihidrata dihidrata, raztopinami vodne raztopine dikromata nad 86 ° C ali sušenjem raztopin natrijevega dikromata v pršilnih sušilnikih..
Raztopine natrijevega dikromata s 69 in 70% m / v uporabimo kot priročno in stroškovno učinkovito metodo pošiljanja količin, pri čemer se izognemo potrebi po ročnem premeščanju ali raztapljanju kristalov..
Reaktivnost in nevarnosti
Je močno oksidacijsko sredstvo. Nezdružljivo z močnimi kislinami. Stik z vnetljivimi materiali lahko povzroči požar. Toksične hlape kromovega oksida se lahko tvorijo v prisotnosti toplote ali požara.
Znana "mešanica kromove kisline" dikromata in žveplove kisline z organskimi ostanki povzroča nasilno eksotermno reakcijo. Ta mešanica v kombinaciji z acetonskimi ostanki vodi tudi v nasilno reakcijo.
Kombinacija dikromata in žveplove kisline z alkoholi, etanolom in 2-propanolom povzroči nasilno eksotermno reakcijo. Zaradi številnih incidentov, ki vključujejo mešanje dikromat-žveplove kisline z organskimi snovmi, ki se lahko oksidirajo, se je verjetno najbolje izogniti takim interakcijam..
Kombinacija dikromata s hidrazinom je eksplozivna, pri čemer se lahko pričakuje, da je reakcija dikromata močna z amini na splošno. Dodajanje dehidrirane dikromatne soli anhidridu ocetne kisline vodi do dokončne eksplozivne eksotermne reakcije.
Bor, silicij in dikromati tvorijo pirotehnične mešanice. Mešanica ocetne kisline, 2-metil-2-pentenala in dikromata vodi do hitre reakcije (Chemical Datasheet natrijev dikromat., 2016)..
Vdihavanje prahu ali meglice povzroča draženje dihal, ki včasih spominja na astmo. Lahko se pojavi perforacija. Šteje se za strup.
Zaužitje povzroča bruhanje, drisko in, zelo nenavadno, zaplete želodca in ledvic. Stik z očmi ali kožo povzroča lokalno draženje. Ponavljajoča izpostavljenost koži povzroča dermatitis.
Natrijev dikromat je rakotvorna snov pri ljudeh. Obstajajo dokazi, da lahko šestvalentne kromove spojine ali Cr (VI) povzročijo rak na pljučih pri ljudeh. Dokazano je, da natrijev dikromat pri živalih povzroča raka na pljučih.
Čeprav natrijev dikromat ni bil opredeljen kot teratogena spojina ali reproduktivno tveganje, je znano, da so šestvalentne kromove spojine ali Cr (VI) teratogene in povzročajo reproduktivne poškodbe, kot so zmanjšanje plodnosti in motnje menstrualnega cikla..
Natrijev dikromat lahko povzroči poškodbe jeter in ledvic, zato ga je treba upravljati zelo skrbno (Department of Health, New Jersey, 2009).
V primeru zaužitja mora žrtev piti vodo ali mleko; nikoli ne sprožite bruhanja. V primeru stika s kožo ali očmi je treba zdraviti kot kislinske opekline; Oči izpirajte z vodo vsaj 15 minut.
Zunanje lezije lahko drgnete z 2% raztopino natrijevega tiosulfata. V vseh primerih se je treba posvetovati z zdravnikom.
Uporabe in aplikacije
Poleg njegove pomembnosti pri proizvodnji drugih kromovih kemikalij ima natrijev dikromat tudi veliko neposrednih uporab kot sestavino pri proizvodnji:
- Kovinska obdelava: pomaga pri odpornosti proti koroziji in čiščenju kovinskih površin, prav tako daje prednost lepljenju barve.
- Organski proizvodi: uporabljajo se kot oksidanti pri proizvodnji izdelkov, kot sta vitamin K in vosek.
- Pigmenti: uporabljajo se za izdelavo anorganskih kromatnih pigmentov, kjer proizvajajo vrsto barv, stabilnih na svetlobo. Nekatere vrste kromata se uporabljajo tudi kot zaviralci korozije v spodnjih slojih in temeljnih premazih.
- Keramika: uporablja se pri pripravi barvnih stekel in keramičnih glazur.
- Tekstil: uporablja se kot lužilo za kisla barvila, da se izboljšajo njegove hitre barvne lastnosti.
- Proizvodnja kromovega sulfata.
(Natrijev dikromat, Gradnik za skoraj vse druge kromove spojine., 2010-2012)
Natrijev dikromat Dihidrat, njegova uporaba je idealna v različnih pogojih, vključno z visokotemperaturnimi aplikacijami, kot so keramične glazure in barvno steklo..
Kromov oksid, ki je trši od drugih kovinskih oksidov, kot sta titan ali železo, je idealen za okolja, kjer so temperature in procesni pogoji agresivni.
Ta snov se uporablja predvsem za proizvodnjo drugih kromovih spojin, vendar se uporablja tudi v blatu iz bentonita, ki se uporablja pri proizvodnji olja, v sredstvih za zaščito lesa, pri proizvodnji organskih kemikalij in kot inhibitor korozije..
Kromov oksid pri mešanju z aluminijem in kalijevim dikromatom proizvaja kovinski krom visoke čistosti. To je bistvena sestavina pri proizvodnji superzmogljivosti, ki se uporabljajo v vesoljski industriji.
Pri organski sintezi uporabimo natrijev dikromat kot oksidacijsko sredstvo v reakcijah redukcijskih oksidov v prisotnosti žveplove kisline.
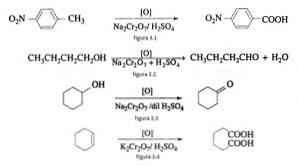
Na primer oksidacija p-nitrotoluena, da se tvori p-nitrobenzojska kislina, pri oksidaciji n-butanola, da nastane n-butaldehid, pri nastajanju cikloheksanona iz cikloheksanola in tvorbe adipinske kisline, kot je prikazano na slikah 3.1 , 3.2, 3.3 in 3.4 (VK Ahluwalia, 2004).
Biokemija
Intratrahealno vkapanje natrijevega dikromata (CrVI) in krom acetat hidroksida (CrIII) pri podganjih samcih je povzročilo povečanje koncentracije kroma v polni krvi, plazmi in urinu do 72 ur po izpostavljenosti; Najvišje koncentracije so bile dosežene po 6 urah po izpostavitvi.
Razmerje med koncentracijo kroma v polni krvi in plazemskim kromom se je bistveno razlikovalo pri zdravljenju s Cr (VI) in Cr (III). Zato je treba za oceno izpostavljenosti kromu uporabiti analize kroma v krvi in kroma v plazmi.
Krom smo odkrili tudi v perifernih limfocitih. Cr (VI), vendar ne Cr (III), se je po zdravljenju pomembno kopičil v limfocitih. Te celice se lahko uporabijo kot biomarkerji pri ocenjevanju izpostavljenosti kromovim spojinam (Hooth, 2008)..
Reference
- Tehnični list kemije Natrijev dikromat. (2016). Pridobljeno iz kamero kemikalij: cameochemicals.noaa.
- Hooth, M.J. (2008). Tehnično poročilo o študijah toksikologije in rakotvornosti natrijevega dikromata. Nacionalni inštitut za zdravje ZDA.
- Kogel, J. E. (2006). Industrijski minerali in kamnine: blago, trgi in uporaba sedme izdaje. littleton colorado: družba rudarstva, metalurgije in raziskovanja inc.
- Nacionalni center za biotehnološke informacije. (s.f.). PubChem Compound Database; CID = 25408. Vzpostavljeno iz pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Ministrstvo za zdravje v New Jerseyju. (2009, november). hazartdozna snov, list natrijevega dikromata. Vzpostavljeno iz nj.gov: nj.gov.
- Natrijev dikromat. Gradnik za skoraj vse druge kromove spojine. (2010-2012). Vzpostavljeno iz elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Celovita praktična organska kemija: preparati in kvantitativne analize. Delhi: Univerzitetni tisk (Indija).


