Vrste, lastnosti, nomenklatura, uporabe in primeri ketonov
The ketoni so organske spojine, ki imajo karbonilno skupino (-CO). So preproste spojine, v katerih je ogljik karbonilne skupine vezan na dva ogljikova atoma (in njihove substitucijske verige). Ketoni so "preprosti", ker nimajo reaktivnih skupin, kot so -OH ali -Cl, vezane na ogljik.
Nazadnje, izločanje ketonov iz človeškega telesa je običajno povezano z nizko vsebnostjo sladkorja (pri diabetičnih primerih in / ali ekstremnem tešče), kar lahko povzroči resne zdravstvene težave za bolnika..
Indeks
- 1 Splošna formula ketonov
- 2 Vrste ketonov
- 2.1 Glede na strukturo vaše verige
- 2.2 Glede na simetrijo svojih radikalov
- 2.3 Glede na nasičenost njenih radikalov
- 2.4 Diketoni
- 3 Fizikalne in kemijske lastnosti ketonov
- 3.1 Vrelišče
- 3.2 Topnost
- 3.3 Kislost
- 3.4 Reaktivnost
- 4 Nomenklatura
- 5 Razlika med aldehidi in ketoni
- 6 Uporaba v industriji in vsakdanjem življenju
- 7 Primeri ketonov
- 7.1 Butanon (C4H8O)
- 7.2 Cikloheksanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Reference
Splošna formula ketonov
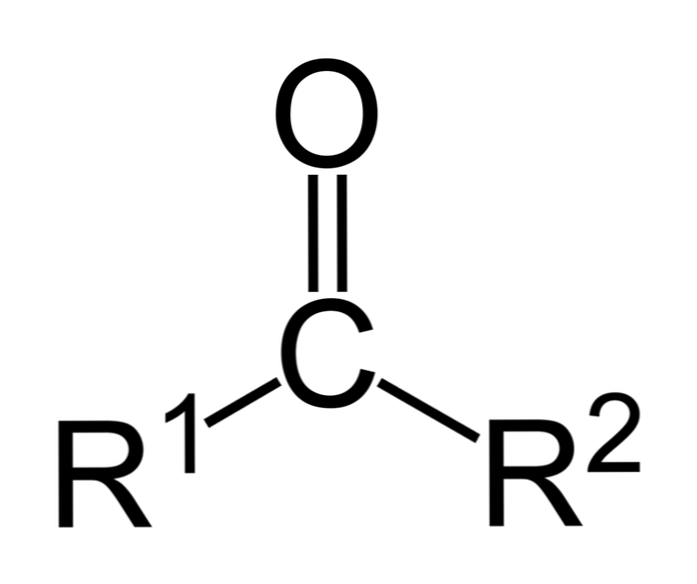
Ketoni so karbonilne spojine, v katerih je ta skupina vezana na dve ogljikovodični skupini; to so lahko alkilne skupine, benzenske obročne skupine ali oboje.
Keton lahko preprosto predstavimo kot R- (C = O) -R ', kjer sta R in R' katerikoli dve ogljikovodikovi verigi (alkani, alken, alkini, cikloalkani, derivati benzena in drugi). Na karbonilno skupino ni vezanih ketonov z vodikom.
Obstaja veliko različnih metod za pripravo ketonov v industrijskem in laboratorijskem okolju; Poleg tega je pomembno omeniti, da lahko ketone sintetizirajo različni organizmi, vključno z ljudmi.
V industriji je najpogostejša metoda za sintezo ketonov oksidacija ogljikovodikov, običajno z uporabo zraka. V manjšem obsegu se ketoni običajno pripravijo z oksidacijo sekundarnih alkoholov, ki kot produkt daje keton in vodo..
Poleg teh najpogostejših metod se lahko ketoni sintetizirajo prek alkenov, alkinov, soli dušikovih spojin, estrov in mnogih drugih spojin, kar omogoča enostavno pridobivanje..
Vrste ketonov
Za ketone obstaja več razvrstitev, ki so odvisne predvsem od substituentov v njihovih verigah R. V nadaljevanju so navedene najpogostejše klasifikacije za te snovi:
Glede na strukturo vaše verige
V tem primeru je keton uvrščen po načinu, po katerem je njegova veriga strukturirana: alifatski ketoni so tisti, ki imajo dva radikala R in R ', ki imata obliko alkilnih radikalov (alkani, alken, alkini in cikloalkani)..
Aromati so tisti, ki tvorijo benzenske derivate, medtem ko so še vedno ketoni. Končno, mešani ketoni so tisti, ki imajo radikal R alkil in R 'arilni radikal, ali obratno.
Glede na simetrijo njegovih radikalov
V tem primeru preučujemo radikale R in R 'substituente karbonilne skupine; kadar so ti enaki (identični), se keton imenuje simetričen; ko pa so različni (kot večina ketonov), se to imenuje asimetrično.
Glede na nasičenost njenih radikalov
Ketone lahko razvrstimo tudi glede na nasičenost njihovih ogljikovih verig; Če so v obliki alkanov, se keton imenuje nasičen keton. V nasprotju s tem, če se verige nahajajo kot alkeni ali alkini, se keton imenuje nenasičen keton..
Dicetoni
To je ločen razred ketona, ker imajo verige tega ketona v svoji strukturi dve karbonilni skupini. Nekateri od teh ketonov imajo edinstvene lastnosti, kot je daljša vezna dolžina med ogljiki.
Diketoni, pridobljeni iz cikloheksana, so na primer poznani kot kinoni, ki so le dva: orto-benzokinon in para-benzokinon.
Fizikalne in kemijske lastnosti ketonov
Ketoni, kot večina aldehidov, so tekoče molekule in imajo vrsto fizikalnih in kemijskih lastnosti, ki se razlikujejo glede na dolžino njihovih verig. Njegove lastnosti so opisane spodaj:
Vrelišče
Ketoni so zelo hlapni, zelo polarni in ne morejo darovati vodikovih vodikovih vezi (nimajo vodikovih atomov, vezanih na njihovo karbonilno skupino), zato imajo višje vrelišče kot alkeni in etri, toda nižje kot \ t alkoholi z enako molekulsko maso.
Vrelišče ketona se poveča z naraščanjem velikosti molekule. To je posledica intervencije van der Waalsovih sil in dipol-dipolnih sil, ki zahtevajo večjo količino energije za ločevanje atomov in elektronov, ki jih pritegne molekula..
Topnost
Topnost ketonov ima močan vpliv deloma na sposobnost teh molekul, da sprejmejo vodike v svojem kisikovem atomu in tako tvorijo vodikove vezi z vodo. Poleg tega se med ketoni in vodo oblikujejo privlačne, sipanje in dipol-dipolske sile, ki povečajo njihov topni učinek..
Ketoni izgubijo sposobnost topnosti, večja je njihova molekula, saj začnejo zahtevati več energije za raztapljanje v vodi. Prav tako so topne v organskih spojinah.
Kislost
Zaradi karbonilne skupine imajo ketoni kislinsko naravo; to se zgodi zaradi zmogljivosti rezonančne stabilizacije te funkcionalne skupine, ki lahko prenese protone iz svoje dvojne vezi, da tvorijo konjugirano bazo, imenovano enol.
Reaktivnost
Ketoni so del velikega števila organskih reakcij; to se zgodi zaradi občutljivosti njegovega karbonilnega ogljika na nukleofilni dodatek poleg polarnosti tega.
Kot je navedeno zgoraj, je zaradi visoke reaktivnosti ketonov priznan vmesni proizvod, ki služi kot osnova za sintezo drugih spojin.
Nomenklatura
Ketoni so poimenovani glede na prednost ali pomen karbonilne skupine v celotni molekuli, tako da, če imate molekulo, ki jo ureja karbonilna skupina, se keton poimenuje z dodajanjem pripone "-one" imenu ogljikovodika..
Najdaljšo verigo s karbonilno skupino vzamemo kot glavno verigo in nato imenujemo molekulo. Če karbonilna skupina nima prednost pred drugimi funkcionalnimi skupinami molekule, potem je identificirana z "-oxo"..
Za bolj zapletene ketone lahko položaj funkcionalne skupine identificiramo s številom, pri diketonih (ketoni z dvema enakima R in R 'substituentoma) pa imenujemo molekulo s pripono "-dion"..
Končno, lahko tudi besedo "keton" uporabimo po identifikaciji verig radikalov, vezanih na karbonilno funkcionalno skupino.
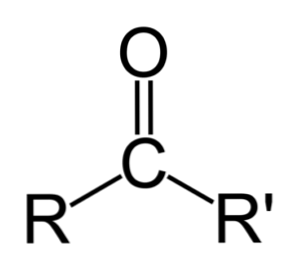
Razlika med aldehidi in ketoni
Največja razlika med aldehidi in ketoni je prisotnost atoma vodika, vezanega na karbonilno skupino v aldehidih..
Ta atom ima pomemben učinek, ko gre za vključitev molekule v oksidacijsko reakcijo: aldehid bo tvoril karboksilno kislino ali sol karboksilne kisline, odvisno od tega, ali pride do oksidacije v kislih ali bazičnih pogojih..
Nasprotno pa keton nima tega vodika, zato se minimalni koraki, potrebni za oksidacijo, ne pojavijo.
Obstajajo metode za oksidacijo ketona (z oksidacijskimi sredstvi, ki so veliko močnejši od tistih, ki se običajno uporabljajo), vendar ti razgrajujejo molekulo ketona in jo ločijo najprej na dva ali več delov..
Uporablja se industrijsko in vsakdanje življenje
V industriji so ketoni pogosto opaženi v parfumih in barvah, pri čemer imajo vlogo stabilizatorjev in konzervansov, ki preprečujejo degradacijo drugih sestavin mešanice; imajo tudi širok spekter topil v tistih industrijah, ki poleg farmacevtskih izdelkov proizvajajo tudi eksplozive, barve in tekstil.
Aceton (najmanjši in najpreprostejši keton) je topilo, priznano po vsem svetu, in se uporablja kot sredstvo za odstranjevanje barve in razredčilo..
V naravi se ketoni lahko pojavijo kot sladkorji, imenovani ketoze. Ketoze so monosaharidi, ki vsebujejo en keton na molekulo. Najbolj znana ketoza je fruktoza, sladkor v sadju in med.
Biosinteza maščobnih kislin, ki se pojavi v citoplazmi živalskih celic, se pojavi tudi z delovanjem ketonov. Nazadnje in kot je bilo omenjeno zgoraj, lahko pride do povišanja ketonov v krvi po postu ali pri diabetičnih primerih.
Primeri ketonov
Butanon (C4H8O)
Znana tudi kot MEK (ali MEC), se ta tekočina proizvaja v velikem obsegu v industriji in se uporablja kot topilo.
Cikloheksanon (C6H10O)
Proizveden v masivnem merilu, se ta keton uporablja kot predhodnik sintetičnega najlona.
Testosteron (C19H22O2)
Je glavni hormon moškega spola in anabolični steroid, ki ga najdemo v večini vretenčarjev.
Progesteron (C21H30O2)
Endogeni steroid in spolni hormoni, ki sodelujejo pri menstrualnem ciklusu, nosečnosti in embriogenezi pri ljudeh in drugih vrstah.
Reference
- Wikipedija. (s.f.). Keton Vzpostavljeno iz en.wikipedia.org
- Britannica, E. (s.f.). Keton Vzpostavljeno iz britannica.com
- University, M.S. (s.f.). Aldehidi in ketoni. Pridobljeno s kemije.msu.edu
- ChemGuide. (s.f.). Uvajanje aldehidov in ketonov. Vzpostavljeno iz chemguide.co.uk
- Calgary, U. O. (s.f.). Ketoni. Vzpostavljeno iz chem.ucalgary.ca


