Butino struktura, lastnosti in uporaba
The butino je kemična spojina, ki spada v skupino alkinov, značilna predvsem po tem, da ima v svoji strukturi vsaj trojno vez med dvema ogljikovima atomoma.
Ko gre za določitev pravil za poimenovanje alkinov je IUPAC (kratica za Mednarodne zveze za čisto in uporabno kemijo), je bilo ugotovljeno, da se uporabljajo tudi za alkenov.

Temeljna razlika med nomenklaturo obeh vrst snovi je, da se pripona -on spremeni v -ali ko gre za spojine, ki imajo v svoji strukturi trojne vezi..
Po drugi strani, butin sestoji samo iz ogljika in vodika, in prihaja v dveh oblikah: 1-butin, ki je v plinastem stanju v pogojih standardni temperaturi in tlaku (1 atm, 25 ° C); in 2-butin, ki je vrsta v tekoči fazi, ki jo proizvaja kemične sinteze.
Indeks
- 1 Kemijska struktura
- 1.1 1-butino
- 1.2 2-butin
- 2 Lastnosti
- 3 Uporabe
- 4 Reference
Kemijska struktura
V butin molekule znan kot pojav strukturne izomerija položaja, ki je prisotnost teh funkcionalnih skupin v obeh spojinah, pa vsaka od teh so na lokaciji, ki se pojavi veriga.
V tem primeru imata obe obliki butina enako molekulsko formulo; Toda v 1-butinu je trojna vez v ogljiku številka ena, v 2-butinu pa v številki dve. To jih pretvori v izomere položaja.
Zaradi lege trojne vezi v enem od terminalov strukture 1-butin, se šteje kot terminal alkinom, medtem ko je srednji položaj trojne vezi v strukturi 2-butin daje klasifikacijski notranji alkin.
Tako je lahko povezava le med prvim in drugim ogljikom (1-butin) ali med drugim in tretjim ogljikom (2-butin). Razlog za to je uporabljena nomenklatura, kjer bo najnižje možno oštevilčenje vedno dano poziciji trojne obveznice.
1-butino
Spojina, imenovana 1-butin, je znana tudi kot etilacetilen, zaradi svoje strukture in načina, na katerega so razporejeni in vezani njeni štirje atomi ogljika. Vendar, ko govorimo o tem butino nanaša se le na te kemične vrste.
V tej molekuli najdemo trojno vez v terminalnem ogljiku, ki omogoča razpoložljivost atomov vodika, ki mu dajejo veliko reaktivnost.
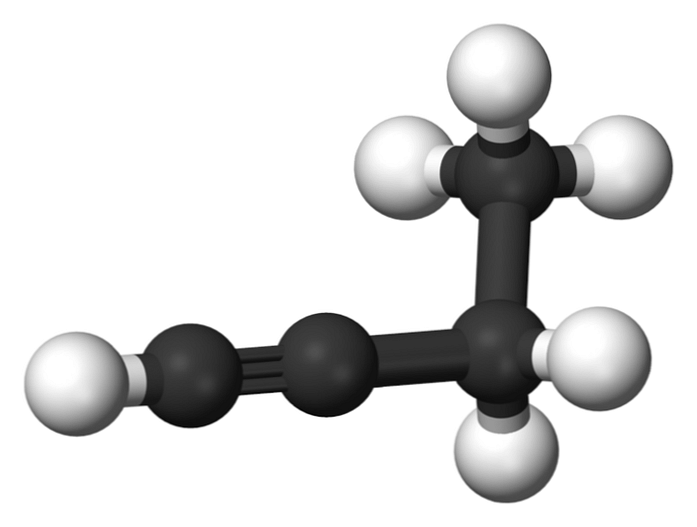
Ta tog in močnejša vez od ene ali dvojne vezi med atomi ogljika zagotavlja stabilno konfiguracijo 1-butinske linearne geometrije.
Po drugi strani pa je ta plinasta snov precej vnetljiva, zato lahko v prisotnosti toplote zlahka povzroči požare ali eksplozije in ima veliko reaktivnost v prisotnosti zraka ali vode..
2-butin
Ker imajo notranji alkini večjo stabilnost kot terminalni alkini, omogočajo transformacijo 1-butina v 2-butin..
To Izomerizacija lahko zgodi s segrevanjem 1-butin v prisotnosti baze (kot NaOH, KOH, NaOCH 3 ...) ali s prenosom 1-butin v raztopini kalijevega hidroksida (KOH) v etanolu (C2H6O).
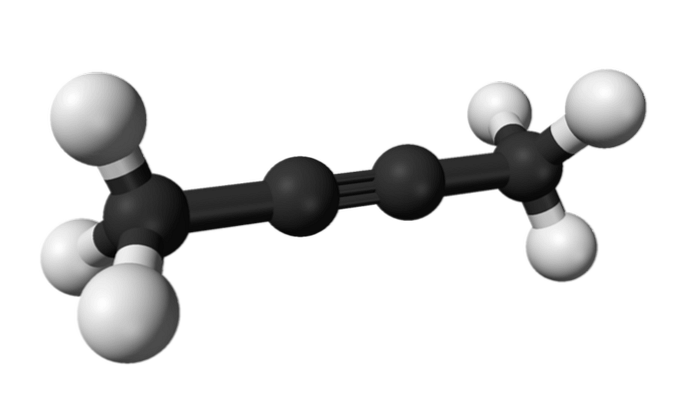
Na enak način se imenuje tudi kemikalija, znana kot 2-butin, dimetilacetilen (ali krotonilen), ki se predstavlja kot tekoča in hlapna vrsta, ki izvira umetno..
V 2-butinu je trojna vez v sredini molekule, kar ji daje večjo stabilnost kot njen izomer.
Poleg tega ima ta brezbarvna spojina manjšo gostoto kot voda, čeprav se v njej šteje za netopno in ima visoko vnetljivost.
Lastnosti
-Strukturna formula butina (ne glede na to, kateri izomer je naveden) je C4H6, ki ima linearno strukturo.
-Ena od kemijskih reakcij, ki jih ima butinska molekula, je izomerizacija, pri kateri pride do prerazporeditve in migracije trojne vezi v molekuli..
-1-Butin je v plinski fazi, ima zelo visoko vnetljivost in večjo gostoto kot zrak.
-Ta snov je prav tako precej reaktivna in v prisotnosti toplote lahko povzroči nasilne eksplozije.
-Poleg tega, ko ta brezbarvni plin doživlja nepopolno reakcijo zgorevanja, lahko povzroči ogljikov monoksid (CO)
-Ko sta oba izomera izpostavljena visokim temperaturam, lahko pride do reakcij polimerizacije eksplozivnega tipa.
-2-butin je v tekoči fazi, čeprav velja tudi za zelo vnetljiv pri standardnih pogojih tlaka in temperature.
-Te snovi se lahko pojavijo nasilne reakcije, kadar so v prisotnosti močnih oksidativnih snovi.
-Na enak način se pri prisotnosti reducirajočih vrst pojavijo eksotermne reakcije s posledično sproščanjem plinastega vodika..
-Če so v stiku z določenimi katalizatorji (kot so nekatere kisle snovi) ali začetnimi vrstami, lahko pride do reakcij polimerizacije eksotermnega tipa..
Uporabe
Ker imajo nekatere različne lastnosti, imata lahko oba izomera različne uporabe in aplikacije, kot je prikazano spodaj:
Prvič, zelo pogosto ena od aplikacij 1-butina je njegova uporaba kot vmesna faza v proizvodnem procesu drugih snovi organske narave sintetičnega izvora..
Po drugi strani pa se ta kemična vrsta uporablja v predelovalni industriji gume in pridobljenih spojin; kot na primer, ko želite dobiti benzol.
Podobno se uporablja v proizvodnem procesu za široko paleto plastičnih izdelkov, kot tudi pri proizvodnji mnogih polietilenskih snovi, ki se štejejo za visoko gostoto..
Prav tako se 1-butin pogosto uporablja kot komponenta za rezanje in varjenje nekaterih kovinskih zlitin, vključno z jeklom (zlitina železa in ogljika)..
V drugem smislu, se izomer 2-butin uporablja v kombinaciji z drugim imenom alkinom propina pri sintezi določenih snovi, znanih kot alkiliranih hidrokinonov, ko se izvaja postopek sinteze a-Skupaj tokoferola (vitamin E).
Reference
- Wikipedija. (s.f.). Butyne Vzpostavljeno iz en.wikipedia.org
- Yoder, C.H., Leber P.A. in Thomsen, M.W. (2010). Most do organske kemije: koncepti in nomenklatura. Vzpostavljeno iz books.google.co.ve
- Study.com. (s.f.). Butin: Strukturna formula in izomeri. Pridobljena iz študije.
- PubChem. (s.f.). 1-Butyne. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butin. Vzpostavljeno iz pubchem.ncbi.nlm.nih.gov


