Značilnosti raztopine, razlike z raztopino in topilom, primeri
The topljenca, v raztopini,snov, ki se raztopi v topilu. Na splošno se raztopina nahaja v manjšem deležu in je lahko trdna, tekoča ali plinasta. Nasprotno, topilo je sestavni del raztopine, ki je v večji količini.
Na primer, v slanici, sol je raztopina in voda je topilo. Vendar pa niso vse raztopine trdne ali topila tekoča.

V tem smislu obstaja več možnih kombinacij raztopin in topil: plin v tekočini, plin v trdni snovi, tekočina v tekočini, tekočina v trdni, trdni v tekoči ali trdni v trdni snovi.
Da bi prepoznali, kaj je raztopina v rešitvi, je treba upoštevati dva vidika. Prvič, topnost je snov, ki je v manjšem deležu. Poleg tega je tisto, ki spremeni svoje fizikalno stanje (trdno, tekoče ali plinasto), ko je integrirano v raztopino.
Indeks
- 1 Raztopine, topila in raztopine
- 2 Opredelitev raztopine
- 3 Značilnosti
- 3.1 Topnost
- 3.2 Temperatura
- 3.3 Nasičenost raztopine
- 3.4 Tlak
- 3.5 Polarnost
- 4 Razlike med topilom in topilom
- 5 Primeri raztopine
- 5.1 Raztopine v plinastem stanju
- 5.2 Raztopine v trdnem stanju
- 5.3 Raztopine v tekočem stanju
- 5.4 Soluti, ki jih lahko uporabljate doma
- 6 Reference
Raztopine, topila in raztopine
V kemiji so homogene mešanice, ki so po vsebini sestavljene iz enakih deležev. Ena najpogostejših vrst homogenih mešanic so raztopine, ki so stabilne homogene mešanice dveh ali več snovi, pri čemer se topnost raztopi v topilu..
Rešitve, topila in raztopine opazimo v vsakodnevnih situacijah in v območju, ki se razlikuje od industrijske do laboratorijske. Te snovi, ki nastanejo iz zmesi, so predmet študij zaradi značilnosti, ki jih predstavljajo, in sil in / ali zanimivosti, ki se pojavljajo med njimi..
Opredelitev raztopine
Kot je navedeno zgoraj, je raztopina tista snov, ki se raztopi v drugo, imenovano topilo.
Običajno ima raztopina manjši delež in se lahko pojavi v kateri koli od treh snovi. Kadar je raztopina podana med dvema snovma, ki sta v isti fazi, se uporabi metoda izbire, da se v manjšem deležu uporabi, da se opredeli, katera je topnost in kateri je topilo.
Zmogljivost raztapljanja raztopine bo odvisna od topnosti. Temperatura topila je tudi odločilni dejavnik, ko gre za poznavanje možnosti oblikovanja ali ne raztopine, ker je višja temperatura topila, večja je količina topila, ki se lahko raztopi v tem.
Obstajajo snovi, ki se imenujejo površinsko aktivne snovi in postanejo manj topne pri višjih temperaturah, vendar so izjeme in izpolnjujejo določene vloge.
Postopek, pri katerem topilo medsebojno deluje z raztopino, da nastane raztopina, je opredeljen kot solvatacija in vključuje tvorbo vezi in vodikovih mostov, poleg atrakcij, ki jih opravljajo van der Waalsove sile..
Funkcije
Raztopljene snovi vsebujejo veliko različnih kemičnih snovi v različnih stanjih, imajo različne kapacitete raztapljanja in imajo številne značilnosti, ki imajo pomembno vlogo pri nastajanju homogenih mešanic. Nekatere glavne značilnosti raztopin so naslednje:
Topnost
Topnost je sposobnost spojine, da se raztopi v drugi snovi. Ta sposobnost je tesno povezana z mešljivostjo, to je sposobnost tekočine, da se meša s specifično; Če se ne morete pridružiti, je to nemešljivost.
Mešljivost ima več kot določeno število, zato lahko rečemo, da se ena snov popolnoma, delno ali ne meša v drugi.
Topna lastnost raztopine je odvisna od drugih dejavnikov, ki lahko povečajo ali zmanjšajo to zmogljivost zaradi vpliva teh na ravnovesje medmolekularnih sil, ki nastanejo med topilom in topilom.
Še manj pričakovane lastnosti, kot je velikost kapljice raztopine ali vrstni red v strukturi kristala, lahko vplivajo na njihovo sposobnost raztapljanja.
Temperatura
Temperatura sistema, v katerem se raztapljena raztopina lahko raztopi, lahko vpliva na njeno topnost: pri večini trdnih snovi in tekočin to poveča njegovo sposobnost raztapljanja glede na povišanje temperature..
V nasprotju s tem pa se pri plinih opazi kompleksno obnašanje, ki je prikazano kot nižja topnost v vodi pri višjih temperaturah, vendar večja v organskih topilih..
Nasičenost raztopine
To se imenuje nasičenost raztopine do stopnje, do katere je raztopina raztopila soluto, ki se imenuje nasičena raztopina za tisto, ki se je raztopila v čim večji količini raztopljene snovi. Od te točke se bo dodana raztopina oborila kot presežek na dnu uporabljene posode; pred tem raztopino imenujemo nenasičena.
Možno je prenesti točko nasičenosti in nadaljevati raztapljanje raztopine, vendar je to potrebno za povišanje temperature. Raztopina, ki vsebuje presežek raztopine in ki je bila segreta, se imenuje preveč nasičena raztopina.
Pritisk
Spremembe tlaka običajno ne vplivajo na topnost trdnih snovi in tekočin, razen nekaterih izjemnih primerov (kopičenje kalcijevega sulfata v naftnih ceveh), v plinih pa je odločilni dejavnik njihove sposobnosti raztapljanja..
Pravzaprav je topnost plina v topilu neposredno sorazmerna z delnim tlakom tega plina na omenjenem topilu.
Polarnost
Polarnost topila je ključnega pomena pri merjenju njegove sposobnosti raztapljanja; raztopina se bolje raztopi v topilu s kemijsko strukturo, ki je podobna tisti, ki jo ima.
Na primer, visoko polarne ali hidrofilne snovi bodo imele večjo topnost v zelo polarnih topilih, medtem ko bodo praktično netopne v nepolarnih snoveh..
Podobno imajo medmolekularne sile pomembno vlogo pri solvataciji in lahkoto, s katerim lahko topilo raztopi solutec: večja dipol-dipolska sila, vodikove vezi in druge vezi, večja je sposobnost topila za raztapljanje raztopi in tvori raztopino.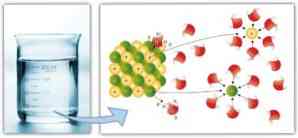
Razlike med topilom in topilom
- Raztopina je snov, ki se raztopi; topilo je sredstvo za raztapljanje topila \ t.
- Raztopina je lahko v trdni, tekoči ali plinski fazi; topilo je običajno v tekoči fazi, vendar obstaja tudi v trdnem in plinastem stanju.
- Topnost topne snovi je bolj odvisna od lastnosti, kot je površina; Kapaciteta solvata je med drugim odvisna od polarnosti, temperature in tlaka.
- Raztopina je ponavadi želena komponenta, ki jo je treba ekstrahirati v industrijskih postopkih; Topilo običajno ni želena komponenta in se zavrže v industrijskih postopkih.
Primeri raztopine
- Sladkor je primer trdne faze, ki se običajno uporablja za sladkanje vode.
- Heksan lahko najdemo v parafinskem vosku, ki služi kot tekoča raztopina, zaradi česar je ta trdna snov bolj voljna.
- Ogljikov dioksid je plin, ki se dodaja pijačam, da se jim da vnetljivost.
Solutos v plinastem stanju
Ogljikov dioksid v vodi (brezalkoholne pijače) \ t
Ogljikova voda je voda, ki vsebuje ogljikov dioksid in se proizvaja s pretokom ogljikovega dioksida pod vodo skozi vodo.
Gazirane mineralne vode se že dolgo pojavljajo naravno. Te šumeče vode obstajajo zaradi presežka ogljikovega dioksida v vodonosniku, ki se je raztopil pod pritiskom.
Eden od najbolj znanih primerov raztopin je komercialna brezalkoholna pijača, ki je kombinirana s sirupom.
Zaradi prisotnosti ogljikovega dioksida so te vode in brezalkoholne pijače bolj privlačne in vizualno privlačne.
Kisik in drugi plini v dušiku (zrak) \ t
Zrak v atmosferi je sestavljen iz molekul različnih plinov. V osnovi je sestavljen iz 78% dušika in približno 21% kisika (raztopine). Poleg tega vsebuje skoraj 1% argona in drugih molekul, vendar v zelo majhnih količinah.
Propan v butanu (plin za kuhanje)
Ta kombinacija, znana tudi kot utekočinjeni naftni plin (LPG), se je začela uporabljati od leta 1860 kot vir goriva za domače namene..
Od takrat je razširila svojo proizvodnjo in porabo za domačo in industrijsko rabo. Ker sta oba plina izjemno brez vonja in nevarna, se doda snov, imenovana merkaptan, ki povzroči zaznavanje uhajanja..
Solutos v trdnem stanju
Bakrov cink (medenina) \ t
Komercialna zlitina, imenovana medenina, se tvori s cinkom (od 5 do 40%), raztopljenim v bakru. Cink pomaga povečati natezno trdnost. Ta zlitina lahko doda tudi druge elemente, kot so kositer, železo, aluminij, nikelj in silicij.
Jod v alkoholu (tinktura joda)
Še en primer popularne znane raztopine je jodna tinktura. Ta raztopina vsebuje jod v etilnem alkoholu (od 44 do 50%). Jodna tinktura se uporablja kot antiseptik.
Sol v vodi (morska voda)
Morska voda pokriva več kot 70% zemeljske površine. To je kompleksna mešanica 96,5% vode, 2,5% soli in manjših količin drugih snovi. Sem spadajo anorganski in raztopljeni organski materiali, delci in nekateri atmosferski plini.
Soluti v tekočem stanju
Alkohol v vodi (alkoholne pijače)
Etanol ali etilni alkohol (solute) iz fermentacije sladkorja se zmeša z vodo v fiksnih razmerjih, da se proizvedejo alkoholne pijače.
Ta spojina se zlahka prebavi v telesu, vendar lahko njena odvečna poraba povzroči resno škodo zdravju.
Voda v zraku (vlažnost v zraku)
Voda v zraku je splošno znana kot megla. To je posledica majhnih kapljic vode, ki so suspendirane v zraku, in je v bistvu posledica ohlajanja zemlje ponoči.
Na ta način to hlajenje povzroči, da okoliški zrak zniža temperaturo. Nato nastopi fenomen, ko se v tem zadrži kondenzirana voda.
Ocetna kislina v vodi (kis) \ t
Kis je tekočina z ostrim okusom, ki se uporablja za dodajanje okusa ali ohranjanje hrane. Pripravi se z raztopino ocetne kisline, pomešane z vodo.
Koncentracija ocetne kisline je spremenljiva. Na primer, destilirana kis ima delež, ki se giblje od 5 do 8%.
Živo srebro v srebru (amalgami ali zobna polnila)
Amalgami, ki se uporabljajo za polnjenje zob, nastanejo z 2% živega srebra z zlitino, ki deluje kot topilo. Ta zlitina vsebuje 70% srebra. Dodate lahko tudi kositer, baker in cink.
Solutos, ki se lahko uporablja doma
Sladkor v vodi
Sladkor je molekularna in polarna spojina in kot taka se lahko raztopi v vodi, ki je tudi polarni element.
Način strukturiranja sladkorja povzroči, da se postopek raztapljanja spreminja. Na primer, če je sladkor v grudicah, bo potrebno več časa, da se raztopi, kot če je v zrnih.
Nekateri strokovnjaki menijo, da je voda s sladkorjem zelo pomemben vir energije za telo. Obstajajo celo študije, ki razkrivajo učinkovitost te rešitve pri ljudeh, ki opravljajo telesno dejavnost.
Sladkor v moki
Za pripravo pogače je običajno, da najprej zmešamo trdne sestavine, nato dodamo tekočine.
Sladkor je zmes, ki je pritrjena na moko in povzroči nastanek osnovne mešanice za pogačo. Poleg teh dveh sestavin se kasneje dodajo še druge, kot so jajca, maslo ali vanilija.
Ta vrsta raztopine je trdna in se v tem primeru zmeša s topilom, ki je tudi trdno. Nastalo podlago lahko uporabite tudi za pripravo sladkih kruhov, piškotov, peciva, gobic, malih pudingov in mnogih drugih sladkih živil..
Sok v prahu v vodi
Obstaja široka paleta sokov v prahu, ki se pripravijo z raztapljanjem tega elementa v vodi. V tem primeru je raztopina sok v prahu in topilo je voda.
Količina topila mora biti večja od količine topila, tako da se običajno ena ali dve žlici sokovega prahu raztopi v kozarcu vode. Celo nekaj praškov, katerih koncentracija je višja in je treba uporabiti manjšo količino.
Obstajajo nasprotniki teh sokov, saj kažejo, da so sestavine, ki jih vsebujejo (kot konzervansi, stabilizatorji in sladila, med drugim) škodljive za zdravje..
Klor v vodi
Eden od načinov za prečiščevanje vode je uporaba klora kot raztopljene raztopine v vodi. Za dezinfekcijsko sredstvo je značilno, da je eden izmed najbolj uporabljenih za odstranjevanje mikroorganizmov, in je idealno, da se nepitljiva voda spremeni v pitno na hiter, ekonomičen in enostaven način..
Klor kot raztopino te raztopine je treba vključiti v vodo pri koncentraciji, ki ni višja od 0,2 in 0,5 miligrama na liter..
Količina klora, ki jo je treba uporabiti, mora biti zelo nizka, ker je lahko ta snov izjemno strupena, kadar jo zaužijemo ali izpostavimo številnim količinam.
Ta metoda čiščenja vode je znana kot kloriranje in jo lahko uporabimo sredi izleta na goro ali obdelamo vodo v domu, da bi odstranili bakterije in mikrobe, ki jih najdemo v ceveh, skozi katere poteka voda..
Barvanje v vodi
Voda je najbolj univerzalno topilo, ki obstaja, in je tudi osnova, na kateri se lahko raztopi raztopina, kot je barva.
Barva se običajno raztopi iz različnih razlogov. Najpogostejša je olajšati čiščenje ščetk in drugih orodij za barvanje.
Obstaja veliko vrst slik; Tisti, ki se najbolje raztopijo v vodi, so lateksi. Poleg tega, da omogočajo boljše čiščenje orodja, je prednost redčenja barve v vodi pred začetkom barvanja, da bo zagotovljena boljša končna obdelava na lakirani površini..
Mlečni prah v vodi
Mlečni prašek je raztopina, ki nastane z dehidracijo mleka, ki je že pasterizirano. Namen tega postopka je zagotoviti, da se mleko lahko shranjuje dlje časa.
Ta raztopina se raztopi v vodi in ustvari tekoče mleko, ki se običajno zaužije ob zajtrku skupaj s kavo ali v različnih pripravkih.
Kot v primeru sokovega prahu mora biti količina mleka, ki jo je treba razredčiti, manjša od količine vode, v kateri želite pripraviti raztopino..
Detergent v vodi
Pri pranju perila se uporabljajo tekoča ali praškasta čistila. Te se raztopijo v vodi, da tvorijo raztopino, ki deluje kot dezinfekcijsko sredstvo in čistilo iz tekstilnih materialov.
Količina raztopine, ki jo je treba uporabiti v tej raztopini, je spremenljiva, odvisno od vrste detergenta, predstavitve iste in sestavin, ki jih ima.
Raztopina detergenta in vode je lahko zelo onesnaževala, ko pride v stik z vodnimi odlagališči, zato je priporočljivo uporabljati biorazgradljive detergente, ki se lahko razgradijo v zelo kratkem času in vplivajo veliko manj na okolje..
Želatina
Želatina je sestavljena iz kite, vezi in živalskih kosti. Ta spojina je lahko v prahu ali v listih.
V obeh primerih je treba to topilo raztopiti v vroči vodi, da se doseže končni rezultat: sladka hrana, ki je idealna za sladico in ima veliko zdravstvenih koristi.
Med prednostmi te spojine je, da daje prednost hitremu popravilu tkiv in je protivnetno živilo. Poleg tega ima veliko beljakovin in igra pomembno vlogo pri utrditvi imunskega sistema.
Jedo malo dnevne količine želatine bo pomagalo regenerirati sklepe in tako predvideti pojav osteoporoze..
Čokolada v mleku
Čokolada je element, ki nastane zaradi mešanice kakava in kakavovega masla. Ta hrana deluje kot zmes, kadar je zmešana z mlekom, da pripravi splošno znano kot vroča čokolada.
Za ta pripravek se segreje želena količina mleka in doda čokolada v kosih, v prahu ali tekočini, neprestano mešanje.
Da bi se ta topnost čim bolje raztopila in se izognili grudicam, je treba mešanico premagati brez premora.
Kakav v prahu v vodi
Pripravite lahko tudi vročo čokolado z uporabo kakava v prahu. To topilo nastane le z maso prahu kakava. Za razliko od čokolade, kakav ne vsebuje masla tega sadja.
Kakav se lahko popolnoma raztopi v vodi, da nastane pijača z okusom čokolade. V teh primerih je bistveno, da se zmes sladi sladkor, med ali nekaj sladila; v nasprotnem primeru bo rezultat zelo grenak.
Reference
- Lambert, N. in Mohammed, M. (1993). Kemija za CXC. Oxford: Heinemann.
- Steen, D. P. (2008). Ogljikov dioksid, karbonacija in principi tehnologije polnjenja. V D. P. Steen, Philip in P. R. Ashurst (uredniki), gazirane brezalkoholne pijače: formulacija in proizvodnja, str. 112-143. Oxford: Blackwell Publishing.
- Kaj je v zraku? (s / f). Center za znanstveno izobraževanje UCAR. Pridobljeno 17. oktobra 2017, iz eo.ucar.edu
- Utekočinjeni naftni plin. (2013, 12. julij). Enciklopedija Britannica.
Pridobljeno 16. oktobra 2017, iz britannica.com - Lytle, D.A. in Schock, M.R. (1996). Stagnacijski čas, sestava, PH in učinki ortofosfata na izluževanje kovin iz medenine. Ohio: ZDA Agencija za varstvo okolja.
- Crabwee, T. D .; Pelletier, S.J. in Pruett, T.L. (2001). Kirurški Antisepsis V S. S. Block (urednik), dezinfekcija, sterilizacija in ohranjanje, str. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R. H. et al (2017, 7. junij). Morska voda. Enciklopedija Britannica. Pridobljeno 17. oktobra 2017, iz britannica.com
- Plutowska B. in Wardencki, W. (2012). Plinska kromatografija-olfaktometrija alkoholnih pijač. V J. Piggott (urednik), Alkoholne pijače: senzorično vrednotenje in raziskovanje potrošnikov, str.101-122. Philadelphia: Woodhead Publishing.
- Kaj je megla? (2017, 12. julij). Met Office (Združeno kraljestvo). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16. februar). Kaj je kemijska sestava kisa? Pridobljeno dne 17. oktobra 2017, iz spletnega mesta thoughtco.com
- Phinney, D.J. in Halstead, J.H. (2017). Zobozdravstvena pomoč: celovit pristop. Massachusetts: Cengage Learning.
- Britannica, E. (s.f.). Solution-Chemistry Vzpostavljeno iz britannica.com
- Wikipedija. (s.f.). Topnost. Vzpostavljeno iz en.wikipedia.org
- Classzone (s.f.). Solutes. Vzpostavljeno iz frsd.k12.nj.us
- ChemGuide. (s.f.). Nasičene raztopine in topnost. Vzpostavljeno iz chem.libretexts.org
- Madhusha (s.f.). Razlika med topilom in topilom. Vzpostavljeno iz pediaa.com.


