Reakcija saponizacije in snovi, ki jih je mogoče dobiti
The saponifikacijo Je osnovna hidroliza estra. To pomeni, da ester reagira z bazo (NaOH ali KOH) nepovratno, proizvaja alkohol in karboksilate natrija ali kalija. Beseda pomeni "izdelovanje mila" in je pravzaprav ena najstarejših kemijskih reakcij, ki jih uporablja človeštvo.
V babilonskih časih so s pomočjo pepela, zbranega iz lesa, rastlin in živalskih maščob, izpopolnili umetnost izdelave mila. Zakaj živalske maščobe? Razlog za to je, da je bogat z glicerolskimi triestri (trigliceridi), lesni pepel pa je vir kalija, osnovnega kovine.
V nasprotnem primeru reakcija poteka z nižjim donosom, vendar dovolj, da odraža njene učinke na barve in nekatere površine. Tak je primer oljnih slik, kjer se pigmenti pomešajo z oljem (vir estrov)..
Indeks
- 1 Reakcija saponifikacije
- 1.1 Mehanizem
- 1.2 Kinetika
- 2 Snovi, ki jih je mogoče dobiti saponifikacijo
- 2.1 Delovanje mila s topilom
- 3 Reference
Reakcija saponifikacije
Mehanizem
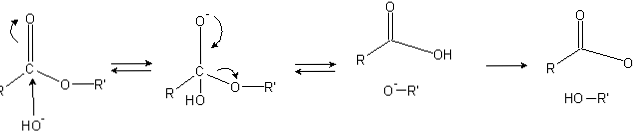
Estri imajo acilno skupino (O = C-R), ki je dovzetna za nukleofilne napade, kot je OH-.
Ker atomi kisika "kradejo" elektronsko gostoto od ogljikovega atoma, je delno nabit, še bolj pa v primeru estrov.
Posledično ta pozitivni naboj privlači negativne vrste, ki lahko oskrbujejo z atomi ogljika elektrone z nukleofilnim napadom (levo stran slike). Posledično nastane tetraedrski vmesni produkt (druga molekula z leve proti desni).
Negativni naboj na kisiku tetraedrskega intermediata je produkt OH- okolico Nato se ta negativni naboj delokalizira, da nastane karbonilna skupina, "nato" prisili "prekiniti vez C-OR '. Tudi ta selitev proizvaja karboksilno kislino RCOOH in alkoksidni ion R'O-.
Končno, ker je reakcijski medij bazičen, alkoksid deprotonira eno molekulo vode in karboksilna kislina reagira z drugim OH- produkta saponifikacije.
Kinetika
Hitrost reakcije saponifikacije je sorazmerna koncentracijam reaktantov. Z drugimi besedami, povečanje koncentracije estra (RCOOR ') ali baze (NaOH) se bo nadaljevalo z višjo stopnjo..
To se prav tako prevede na naslednji način: stopnja saponifikacije je prvi red glede na ester in prvi red glede na bazo. Zgoraj navedeno lahko izrazimo z naslednjo matematično enačbo:
Hitrost = k [RCOOR '] [NaOH]
Pri čemer je k konstantni ali hitrostni koeficient, ki se spreminja v odvisnosti od temperature ali tlaka; to pomeni, da je višja toplota, večja je hitrost saponifikacije. Zato je medij izpostavljen vrenju.
Ker sta oba reagenta kinetičnega prvega reda, je celotna reakcija drugi vrstni red.
V reakcijskem mehanizmu saponifikacije je za nastanek tetraedrskega intermediata potreben nukleofilni napad, ki vključuje tako ester kot bazo.
Kinetika drugega reda se tako odraža v tem dejstvu, ker intervenirajo v (počasnem) determinantnem koraku reakcije..
Snovi, ki se lahko pridobijo s saponifikacijo

Glavni proizvodi umiljenja so alkoholi in soli karboksilnih kislin. V kislem mediju dobimo ustrezen RCOOH, dobljen s saponifikacijo maščob in olj, ki so znani kot maščobne kisline..
Tako so mila sestavljene iz soli maščobnih kislin, ki so posledica umiljenja. Ali greš ven s kakšnimi kationi? Lahko so Na+, K+, Mg2+, Vera3+, itd..
Te soli so topne v vodi, vendar oborijo z delovanjem NaCl, ki se doda mešanici, ki dehidrira milo in ga loči od vodne faze. Reakcija saponifikacije trigliceridov je naslednja: \ t
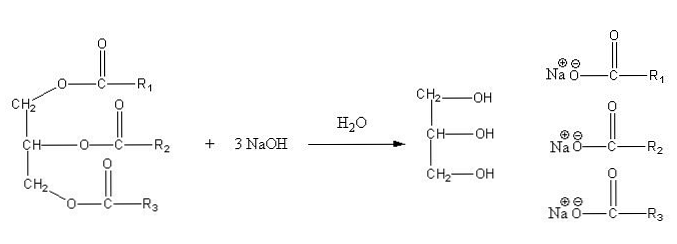
Glicerin je alkoholni "E", milo pa so vse soli nastalih maščobnih kislin. Tu ima vsaka stranska veriga -R različne dolžine in stopnje nenasičenosti. Posledično te verige razlikujejo med maščobami in rastlinskimi olji.
Ključ za izdelavo mila je torej v izbiri najboljših maščob in olj, ali natančneje, pri izbiri različnih virov trigliceridov.
Ta bela milnica lahko v svoji strukturi vsebuje barvila in druge organske spojine, ki dajejo prijetne arome in svetle barve. Od tu se umetnost in poklic v tej trgovini ukvarjajo s številnimi možnostmi.
Vendar pa je saponifikacijska reakcija tudi sintetični način karboksilnih kislin in alkoholov, ki niso nujno povezani z glicerinom ali milom..
Na primer, bazična hidroliza kateregakoli estra, kot je enostaven etil acetat, bo proizvedla ocetno kislino in etanol.
Topilo mila

Soli maščobnih kislin so topne v vodi, vendar ne na enak način, kot so solvati; to je obdano z vodno sfero. V primeru mila se njihove stranske verige -R preprečujejo teoretično, da se raztopijo v vodi.
Zato, da bi preprečili ta energetsko neudoben položaj, so usmerjeni tako, da te verige pridejo v stik in tvorijo nepolarno organsko jedro, medtem ko so polarne glave konec (-COO)- Na+), interakcijo z vodnimi molekulami in ustvarjanje "polarne lupine".
Zgoraj je prikazano na zgornji sliki, kjer je prikazana ta vrsta strukture, znana kot micela.
"Črni repi" ustrezajo hidrofobnim verigam, ki se zapletejo v organsko jedro, zaščiteno s sivimi kroglami. Te sive krogle tvorijo polarni ščit, glave -COO- Na+.
Nato so micele grozdi (kopice) soli maščobnih kislin. V njih lahko zajamejo maščobo, ki je zaradi nepolnega značaja v vodi netopna.
Kako to delajo? Tako maščobne kot tudi -R verige so hidrofobne, tako da imata obe veliko afiniteto drug za drugega.
Ko micele obdajajo maščobe, voda sodeluje s polarno lupino, kar omogoča topnost mila. Podobno so micele negativno nabite, kar povzroča medsebojno odbijanje in s tem generiranje disperzije maščobe..
Reference
- Anne Marie Helmenstine, dr. (3. oktober 2017). Opredelitev in reakcija saponifikacije. Vzpostavljeno 24. aprila 2018, iz: thoughtco.com
- Francis A. Carey. Organska kemija Karboksilne kisline. (šesta izdaja, str. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organska kemija. Lipidi (10. izdaja, Stran 1056-1058). Wiley Plus.
- Wikipedija. (2018). Saponifikacija. Vzpostavljeno 24. aprila 2018, z: en.wikipedia.org
- Boyd C. (27. februar 2015). Razumeti kemijo in zgodovino mila. Vzpostavljeno 24. aprila 2018, od: chemservice.com
- Luca Laghi (27. marec 2007). Saponifikacija. Vzpostavljeno 24. aprila 2018, iz: commons.wikimedia.org
- Amanda Crochet (12. maj 2015). Micelle (sivine). Vzpostavljeno 24. aprila 2018, iz: commons.wikimedia.org


