Vrste dvojnih substitucijskih reakcij in primeri
The dvojno zamenjavo, dvojnega premika ali metateze, je tista, pri kateri pride do dvojne ionske izmenjave med dvema spojinama, brez katerega koli od teh oksidirajočih ali reducirajočih. To je ena izmed najbolj elementarnih kemijskih reakcij.
Nove vezi tvorijo velike elektrostatične sile privlačnosti med ioni. Tudi reakcija daje prednost oblikovanju bolj stabilnih vrst, kot je predvsem vodna molekula. Splošna kemijska enačba za dvojno substitucijsko reakcijo je prikazana na spodnji sliki.
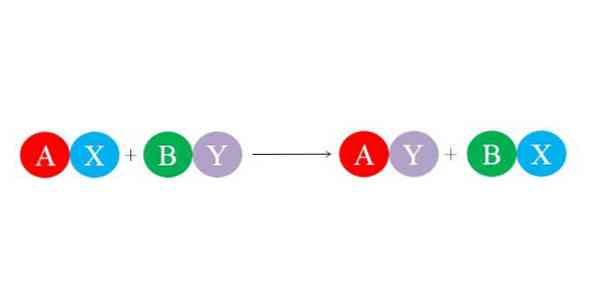
Začetne spojine AX in BY reagirajo z izmenjavo "svojih partnerjev" in tako tvorijo dve novi spojini: AY in BX. Ta reakcija se zgodi, če in samo če sta A in Y bolj povezana kot A in B, ali če so BX povezave stabilnejše od tistih, ki jih ima BY. Ker je reakcija preprosta izmenjava ionov, nobeden od teh ne doseže ali izgubi elektronov (redoks reakcija).
Torej, če je A nabojni kation +1 v spojini AX, bo imel isto spojino +1 v spojini AY. Enako velja za ostale "črke". Ta vrsta reakcije je podpora kislinsko-bazičnih reakcij in nastajanja oborine.
Indeks
- 1 Vrste
- 1.1 Nevtralizacija
- 1.2 Padavine
- 2 Primeri
- 2.1 Primer 1
- 2.2 Primer 2
- 2.3 Primer 3
- 2.4 Primer 4
- 2.5 Primer 5
- 2.6 Primer 6
- 2.7 Primer 7
- 2.8 Primer 8
- 3 Reference
Vrste
Nevtralizacija
Močna kislina reagira z močno bazo za proizvodnjo topnih soli in vode. Ko je ena od obeh - kislina ali baza - šibka, nastala sol ni popolnoma ionizirana; v vodnem mediju, ki je sposoben hidrolize. Prav tako lahko kislino ali bazo nevtraliziramo s soljo.
Zgoraj lahko ponovno predstavimo s kemijsko enačbo s črkami AXBY. Ker pa je Brønstedova kislost prikazana samo s H ioni+ in OH-, ti predstavljajo potem črke A in Y:
HX + BOH => HOH + BX
Ta kemijska enačba ustreza nevtralizaciji, ki je preprosto reakcija med kislino HX in bazo BOH za proizvodnjo HOH (H)2O) in BX sol, ki je lahko ali pa tudi ne topna v vodi.
Vaš skelet se lahko spreminja glede na stehiometrične koeficiente ali naravo kisline (organske ali anorganske)..
Padavine
Pri tej vrsti reakcije je eden od produktov netopen v mediju, navadno voden, in se obori (trdna snov se trdno strdi iz preostale raztopine)..
Shema je naslednja: dve topni spojini, AX in BY, sta zmešani in eden od produktov, AY ali BX, se obori, kar bo odvisno od pravil topnosti:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
V primeru, da sta bili AY in BX netopni v vodi, se bo ta par ionov, ki kažejo najmočnejše elektrostatične interakcije, oboril, kar se lahko kvantitativno odraža v njihovih vrednostih konstante topnosti (Kps)..
Vendar pa je v večini reakcij obarjanja ena sol topna in druge oborine. Obe reakciji - nevtralizacija in obarjanje - se lahko pojavita v isti mešanici snovi.
Primeri
Primer 1
HCl (ac) + NaOH (ac) => H2O (l) + NaCl (ac)
Kakšna je to reakcija? Klorovodikova kislina reagira z natrijevim hidroksidom, zaradi česar nastaja voda in natrijev klorid. Ker je NaCl zelo topen v vodnem mediju in nastala je tudi vodna molekula, je reakcija primera 1 nevtralizacija.
Primer 2
Cu (NO3)2(ac) + Na2S (ac) => CuS (s) + 2NaNO3(ac)
V tej reakciji ni prisoten niti ion H+ niti OH-, in molekula vode ne opazimo na desni strani kemijske enačbe.
Bakrov (II) nitrat ali bakrov nitrat zamenja ione z natrijevim sulfidom. Bakrov sulfid je netopen, saj v nasprotju z natrijevim nitratom topi sol.
Raztopina Cu (NO3)2 modra je, medtem ko je Na2S je rumenkast. Ko sta obe mešani, barve izginejo in CuS se obori, kar je črno trdno snov.
Primer 3
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
Tudi to je druga reakcija nevtralizacije. Ocetna kislina reagira z natrijevim hidroksidom, da tvori natrijevo acetatno sol in vodno molekulo.
Za razliko od primera 1, natrijev acetat ni v celoti ionizirana sol, ker je anion hidroliziran:
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(ac)
Primer 4
2HI (ac) + CaCO3(s) => H2CO3(ac) + CaI2(ac)
V tej reakciji, ki kljub temu, da ni nevtralizirajoča, hidrodna kislina popolnoma reagira z apnencem, da nastane karbonska kislina in kalcijev jodid. Poleg tega sproščanje toplote (eksotermna reakcija) razgrajuje ogljiko kislino v ogljikov dioksid in vodo:
H2CO3(ac) => CO2(g) + H2O (l)
Globalna reakcija ostaja:
2HI (ac) + CaCO3(s) => CO2(g) + H2O (l) + CaI2(ac)
Prav tako kalcijev karbonat, bazična sol, nevtralizira vodno kislino.
Primer 5
AgNO3(ac) + NaCl (ac) => AgCl (s) + NaNO3(ac)
Srebrov nitrat zamenja ione z natrijevim kloridom in tako tvori netopno sol srebrovega klorida (belkasta oborina) in natrijevega nitrata \ t.
Primer 6
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (l) + Ca3(PO4)2(s)
Fosforjeva kislina je nevtralizirana s kalcijevim hidroksidom, kar povzroči tvorbo netopne soli kalcijevega fosfata in šest molov vodnih molekul..
To je primer dvojne reakcije substitucije obeh tipov: nevtralizacija kisline in obarjanje netopne soli.
Primer 7
K2S (ac) + MgSO4(ac) => K2SO4(ac) + MgS (s)
Kalijev sulfid reagira z magnezijevim sulfatom, pri čemer se ioni S raztopijo2- in Mg2+ za tvorbo netopne soli magnezijevega sulfida in topne soli kalijevega sulfata.
Primer 8
Na2S (ac) + HCl (ac) → NaCl (ac) + H2S (g)
Natrijev sulfid nevtralizira klorovodikovo kislino, kar proizvaja natrijev klorid in vodikov sulfid.
V tej reakciji ne tvori voda (za razliko od najpogostejših nevtralizacij), ampak neelektrolitsko molekulo vodikovega sulfida, katere vonj po gnilih jajcih je zelo neprijeten. H2S se izogne raztapljanju v plinasti obliki in ostale vrste ostanejo raztopljene.
Reference
- Whitten, Davis, Peck & Stanley. Kemija (8. izd.). CENGAGE Learning, str. 150-155.
- Quimicas.net (2018). Primeri dvojne reakcije zamenjave. Pridobljeno 28. maja 2018, iz: quimicas.net
- Reakcije metateze. Pridobljeno 28. maja 2018, iz: science.uwaterloo.ca
- Khan Akademija. (2018). Dvojne reakcije zamenjave. Pridobljeno 28. maja 2018, od: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8. maj 2016). Definicija reakcije z dvojno zamenjavo. Vzpostavljeno 28. maja 2018, iz: thoughtco.com


