Magnezijeva hidridna formula, kemijska struktura in lastnosti
The magnezijev hidrid (MgH2 molekularne formule), je kemijska spojina z vsebnostjo 7,66 mas.% vodika in v naravi najdena kot bela kristalna trdna snov. Uporablja se predvsem za pripravo drugih kemičnih snovi, čeprav je bila raziskana tudi kot potencialni medij za shranjevanje vodika.
Spada v družino slanih (ali ionskih) hidridov, ki jih definira H-ion negativno nabite. Ti hidridi se obravnavajo kot tisti, ki nastanejo iz alkalnih kovin in zemeljskoalkalijskih kovin, vendar imajo v primeru magnezija (in berilija) kovalentne vezi, poleg tistih ionov, ki označujejo to družino hidridov..
Indeks
- 1 Priprava in formula
- 2 Kemijska struktura
- 3 Fizikalne in kemijske lastnosti
- 3.1 Fizično
- 3.2 Kemikalije
- 4 Uporabe
- 4.1 Shranjevanje vodika
- 4.2 Reakcije hidrogeniranja in dehidrogenacije
- 4.3 Blato
- 4.4 Gorivne celice
- 4.5 Promet in energija
- 4.6 Alkilacija
- 5 Tveganja
- 5.1 Reakcija z vodo
- 5.2 Je piroforna
- 6 Reference
Priprava in formula
Magnezijev hidrid se tvori z neposrednim hidrogeniranjem magnezijevega (Mg) kovine v pogojih visokega tlaka in temperature (200 atmosfer, 500 ° C) z MgI katalizatorjem.2. Njegova reakcija je enaka:
Mg + H2→ MgH2
Raziskali smo tudi proizvodnjo MgH2 pri nižjih temperaturah z uporabo nanokristalnega magnezija, proizvedenega v krogličnih mlinih.
Obstajajo tudi druge metode priprave, vendar predstavljajo bolj zapletene kemijske reakcije (hidrogeniranje magnezijev-antracena, reakcija med dietilmagnezijem in litij-aluminijevim hidridom in kot produkt kompleksa MgH2).
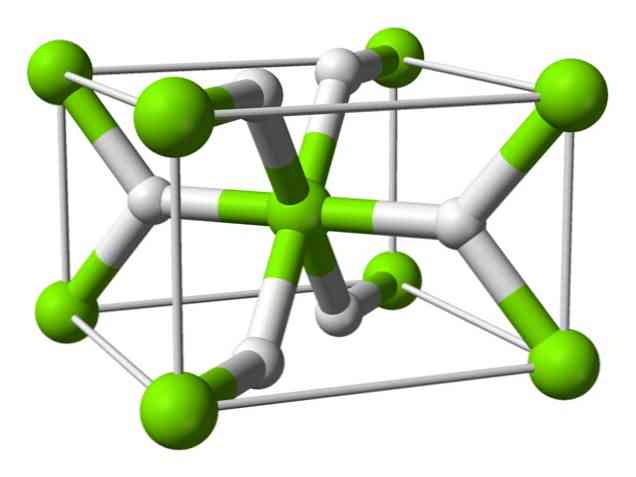
Kemijska struktura
Ta atom ima strukturo rutila pri sobni temperaturi, s tetragonsko kristalno strukturo. V pogojih visokega tlaka ima vsaj štiri različne oblike in opažena je tudi nestehiometrična struktura s pomanjkanjem vodika; slednji se pojavijo le v zelo majhnih količinah delcev, ko se oblikujejo.
Kot je omenjeno zgoraj, imajo vezi, ki obstajajo v rutilni strukturi, delno kovalentne lastnosti, namesto da bi bile čisto ionske, kot druge slane hidride..
To povzroča, da ima atom magnezija sferično obliko, popolnoma ionizirano, vendar ima njen hidridni ion podolgovato strukturo..
Fizikalne in kemijske lastnosti
Fizično
- Videz: Beli kristali.
- Molska masa: 26,3209 g / mol
- Gostota: 1,45 g / cm3
- Tališče: 285 ° C razpade
- Topnost: V vodi se razgradi.
Ta kemijska spojina ima molekulsko maso 26,321 g / mol, gostoto 1,45 g / cm3 in ima tališče 327 ° C..
Kemikalije
- Predhodnik za proizvodnjo drugih kemičnih snovi.
- Shranjevanje vodika kot možen vir energije.
- Reducirno sredstvo v organski sintezi.
Pomembno je navesti, da se ta spojina ne more prenesti v tekoče stanje, in ko se prenaša ali se tališče ali vnaša v vodo, se razgradi. Ta hidrid je netopen v etru.
Je zelo reaktivna in zelo vnetljiva snov ter je tudi piroforna, kar pomeni, da se lahko spontano vžge v zraku. Ti trije pogoji predstavljajo varnostna tveganja, ki bodo omenjena v zadnjem delu tega člena.
Uporabe
Shranjevanje vodika
Magnezijev hidrid z lahkoto reagira z vodo in tvori vodikov plin z naslednjo kemično reakcijo: \ t
MgH2+2H2O → 2H2+Mg (OH)2
Poleg tega se ta snov razgradi pri temperaturi 287 ° C in tlaku 1 bar, kot sledi: \ t
MgH2→ Mg + H2
Zato je bila predlagana uporaba magnezijevega hidrida kot nosilca vodika za njegovo uporabo in transport.
Predlaga se hidrogeniranje in dehidrogeniranje količine kovinskega magnezija kot načina prenosa količin plinastega vodika, s čimer se zagotovi, da v njegovem transportu ni puščanja in da je varnejši in bolj praktičen način kot z uporabo visokotlačnih posod..
Hidrogeniranje in dehidrogeniranje
Čeprav je temperatura razgradnje magnezijevega hidrida omejevalni dejavnik za njeno uporabo, so bile predlagane metode za izboljšanje kinetike hidrogenacijskih in dehidrogenacijskih reakcij. Ena od teh je zmanjšanje velikosti magnezijevega delca z uporabo krogličnih mlinov.
Blato
Poleg tega je bil predlagan sistem, ki proizvaja magnezijev hidrid v obliki blata (bolj obvladljiv in varen od tistega v prahu ali drugih trdnih delcih), ki bi reagiral z vodo, da bi dosegel želeni vodik..
Ocenjuje se, da bi prej omenjeno blato tvorili fino mleti hidrid, zaščiten z zaščitno plastjo olj in suspendiran v dispergirnih sredstvih, da se ohrani njegova konsistenca brez izgube materiala in da ne absorbira vlage iz okolja..
Prednost tega blata je, da se lahko črpa skozi vsako skupno dizelsko gorivo, bencin ali vodno črpalko, tako da je ta ekonomski predlog in tudi učinkovit.
Gorivne celice
Magnezijev hidrid se lahko vgradi v proizvodnjo naprednih gorivnih celic, pa tudi pri izdelavi baterij in shranjevanju energije.
Prevoz in energija
V zadnjih desetletjih je bila upoštevana raba vodika kot vira energije. Za vgradnjo vodika kot goriva je treba najti varne in reverzibilne sisteme za shranjevanje ter z velikimi prostorninskimi zmogljivostmi (količino vodika na enoto prostornine) in gravimetrijo (količino vodika na enoto mase)..
Alkilacija
Alkiliranje (dodamo CH alkilne skupine3R) organskih spojin v osnovnem mediju, kjer je prisotna -OH skupina pri nizkih koncentracijah in temperaturah višja od tališča hidrida \ t.
V tem primeru so vodiki prisotni v magnezijevem hidridu (MgH2), združimo skupine -OH, ki tvorijo vodo. Prosti magnezij lahko prejme halogen, ki pogosto spremlja alkilno molekulo, ki naj bi se vezala na ogljikovodično verigo..
Tveganja
Reakcija z vodo
Kot je bilo že omenjeno, je magnezijev hidrid snov, ki zelo enostavno in silovito reagira z vodo, kar pomeni, da lahko eksplodira pri višjih koncentracijah..
To se zgodi zato, ker njegova eksotermna reakcija proizvede dovolj toplote za vžig plinov vodika, ki se sprošča v reakciji razgradnje, kar vodi do precej nevarne verižne reakcije..
Je piroforičen
Magnezijev hidrid je tudi piroforen, kar pomeni, da se lahko v prisotnosti vlažnega zraka spontano vžge in tvori magnezijev oksid in vodo..
Vdihavanje ni priporočljivo v trdnem stanju ali v stiku z njegovimi hlapi: snov v svojem naravnem stanju in proizvodi razgradnje lahko povzročijo hude poškodbe ali celo smrt..
V stiku z vodo in kontaminacijo lahko povzroči korozivne raztopine. Stik s kožo in očmi ni priporočljiv in povzroča draženje sluznice.
Ni dokazano, da lahko magnezijev hidrid povzroča kronične učinke na zdravje, kot so rak, reproduktivne okvare ali druge fizične ali duševne posledice, vendar je priporočljiva uporaba zaščitne opreme (zlasti respiratorjev ali mask). lik finega prahu).
Pri delu s to snovjo mora biti vlažnost zraka na nizkih ravneh, gasiti vse vire vžiga in jo prevažati v sodih ali drugih zabojnikih..
Vedno se izogibajte delovanju z velikimi koncentracijami te snovi, če se je temu mogoče izogniti, saj se možnost eksplozije znatno zmanjša.
Če pride do razlitja magnezijevega hidrida, je treba delovno območje izolirati in prah zbrati s sesalcem. Nikoli ne uporabljajte metode suhega pometanja; povečuje možnosti reakcije s hidridom.
Reference
- Zumdahl, S. S. (1998). Enciklopedija Britannica. Vzeto iz britannica.com.
- PubChem. (2005). PubChem Open Chemistry Database. Vzeto iz pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Kongres zelenih avtomobilov. Vzeto iz greencarcongress.com.
- Chemicals, C. (n.d.). Cameo Chemicals. Vzeto iz cameochemicals.noaa.gov.
- Services, N.J. (1987). Ministrstvo za zdravje in višje službe New Jerseyja. Vzeto iz nj.gov.


