Struktura, lastnosti, uporabe in tveganja etana
The etan je preprost ogljikovodik s formulo C2H6 z naravo brezbarven in brez vonja plin, ki ima zelo dragoceno in raznoliko uporabo pri sintezi etilena. Poleg tega je to eden od zemeljskih plinov, ki je bil zaznan tudi v drugih planetih in zvezdah okoli sončnega sistema. Odkril ga je znanstvenik Michael Faraday leta 1834.
Med velikim številom organskih spojin, ki jih tvorijo ogljikovi in vodikovi atomi (ti ogljikovodiki), obstajajo tisti, ki so v plinastem stanju pri temperaturah in okoljskih obremenitvah, ki se v mnogih panogah zelo uporabljajo..
Običajno izvirajo iz plinaste mešanice, imenovane "zemeljski plin", ki je proizvod visoke vrednosti za človeštvo in med drugim sestavljajo metan, etan, propan in butan; razvrsti glede na količino ogljikovih atomov v svoji verigi.
Indeks
- 1 Kemijska struktura
- 1.1 Sinteza etana
- 2 Lastnosti
- 2.1 Topnost etana
- 2.2 Kristalizacija etana
- 2.3 Izgorevanje etana
- 2.4 Etan v ozračju in nebesnih telesih
- 3 Uporabe
- 3.1 Proizvodnja etilena
- 3.2 Usposabljanje osnovnih kemikalij
- 3.3 Hladilno sredstvo
- 4 Tveganja etana
- 5 Reference
Kemijska struktura
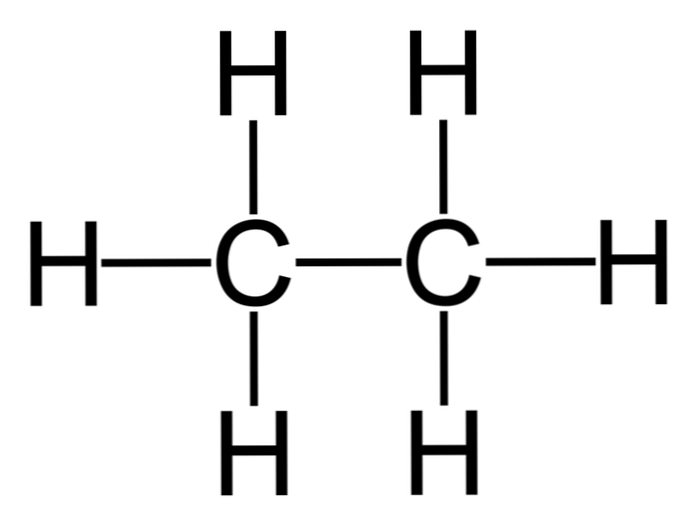
Etan je molekula s formulo C2H6, običajno gledamo kot združitev dveh metilnih skupin (-CH)3), da se tvori ogljikovodik s preprosto vezjo ogljik-ogljik. Je tudi najpreprostejša organska spojina po metanu, predstavljena na naslednji način:
H3C-CH3
Atomi ogljika v tej molekuli imajo sp hibridizacijo3, tako molekularne vezi predstavljajo prosto kroženje.
Obstaja tudi notranji pojav etana, ki temelji na rotaciji molekularne strukture enake in minimalni energiji, ki je potrebna za izdelavo rotacije vezi 360 stopinj, kar znanstveniki imenujejo "etanska pregrada"..
Zato se etan lahko pojavlja v različnih konfiguracijah glede na njegovo rotacijo, čeprav obstaja njegova bolj stabilna konformacija, kjer so vodiki nasproti drugemu (kot je prikazano na sliki)..

Sinteza etana
Etan se lahko enostavno sintetizira iz elektrolize Kolbe, organske reakcije, v kateri se pojavita dva koraka: elektrokemična dekarboksilacija (odstranitev karboksilne skupine in sproščanje ogljikovega dioksida) dveh karboksilnih kislin in kombinacija produktov. intermediatov, da tvorijo kovalentno vez.
Podobno elektroliza ocetne kisline vodi do nastajanja etana in ogljikovega dioksida, ta reakcija pa se uporablja za sintezo prvega \ t.
Oksidacija anhidrida ocetne kisline z delovanjem peroksidov, koncept, podoben konceptu Kolbejeve elektrolize, prav tako povzroči nastanek etana.
Na enak način se lahko učinkovito loči od zemeljskega plina in metana s postopkom utekočinjanja, pri čemer se uporabljajo kriogeni sistemi za zajem tega plina in ločevanje od mešanic z drugimi plini..
Pri tej vlogi je prednosten postopek turbo ekspanzije: mešanica plinov se spušča skozi turbino, kar povzroči njeno ekspanzijo, dokler se temperatura ne spusti pod -100 ° C.
Že na tej točki se lahko sestavine mešanice razlikujejo, tako da bo tekoči etan ločen od plinskega metana in drugih vrst, ki so vključene v destilacijo..
Lastnosti
Etan se v naravi pojavlja kot plin brez vonja in brezbarvnega plina pri standardnih tlakih in temperaturah (1 atm in 25 ° C). Ima vrelišče -88,5 ° C in tališče -182,8 ° C. Poleg tega ni izpostavljena izpostavljenosti močnim kislinam ali bazam.
Topnost etanola
Molekule etana so simetrične konfiguracije in imajo šibke sile privlačnosti, ki jih držijo skupaj, imenovane sile disperzije.
Ko se etan poskuša raztopiti v vodi, so sile privlačnosti, ki nastanejo med plinom in tekočino, zelo šibke, tako da je zelo težko pridružiti etan z molekulami vode..
Zaradi tega je topnost etana precej nizka in se rahlo povečuje, ko se tlak v sistemu dvigne.
Kristalizacija etana
Etan se lahko strdi, kar povzroči nastanek nestabilnih kristalov etana s kubično kristalno strukturo.
Z znižanjem temperature nad -183,2 ° C ta struktura postane monoklinična, kar povečuje stabilnost njegove molekule.
Izgorevanje etana
Ta ogljikovodik se, čeprav se ne uporablja široko kot gorivo, lahko uporablja v procesih zgorevanja za pridobivanje ogljikovega dioksida, vode in toplote, kar je predstavljeno na naslednji način:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Obstaja tudi možnost sežiganja te molekule brez presežka kisika, ki je znana kot "nepopolno zgorevanje", kar povzroči nastanek amorfnega ogljika in ogljikovega monoksida v neželeni reakciji, odvisno od količine uporabljenega kisika. :
2C2H6 + 3O2 → 4C + 6H2O + Heat
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Heat
2C2H6 + 5O2 → 4CO + 6H2O + Heat
Na tem področju zgorevanje poteka skozi vrsto reakcij prostih radikalov, ki so oštevilčene v več sto različnih reakcijah. Na primer, spojine, kot so formaldehid, acetaldehid, metan, metanol in etanol, se lahko tvorijo v nepopolnih reakcijah zgorevanja..
To bo odvisno od pogojev, pod katerimi se reakcija dogaja, in od reakcij prostih radikalov. Etilen se lahko tvori tudi pri visokih temperaturah (600-900 ° C), kar je proizvod, ki ga industrija zelo želi.
Etan v ozračju in nebesna telesa
Etan je v ozračju planeta Zemlje prisoten v sledovih in sumi, da je človeško bitje uspelo podvojiti to koncentracijo, odkar je začel izvajati industrijske dejavnosti.
Znanstveniki menijo, da je velik del sedanje prisotnosti etana v ozračju posledica izgorevanja fosilnih goriv, čeprav se je svetovna emisija etana zmanjšala za skoraj polovico, ker so se izboljšale tehnologije proizvodnje plina iz skrilavca ( vir zemeljskega plina).
Ta vrsta se naravno proizvaja tudi z vplivom sončnih žarkov na atmosferski metan, ki rekombinira in tvori molekulo etana..
Etan obstaja v tekočem stanju na površini Titana, enega od Saturnovih lun. To se v večji količini pojavlja na reki Vid Flumina, ki teče več kot 400 kilometrov proti enemu od svojih morij. Ta spojina je bila dokazana tudi na kometih in na površini Plutona.
Uporabe
Proizvodnja etilena
Uporaba etana temelji predvsem na proizvodnji etilena, najpogosteje uporabljenega ekološkega proizvoda v svetovni proizvodnji, s postopkom, znanim kot parni kreking..
Ta postopek je sestavljen iz prehajanja etana, razredčenega s paro, v peč, ki se hitro ogreje brez kisika.
Reakcija poteka pri izjemno visoki temperaturi (med 850 in 900 ° C), vendar mora biti zadrževalni čas (čas, ki ga porabi etan v pečici) kratek, da bi bila reakcija učinkovita. Pri višjih temperaturah nastane več etilena.
Usposabljanje osnovnih kemikalij
Etan je bil preučen tudi kot glavna sestavina pri tvorbi osnovnih kemikalij. Oksidacijsko kloriranje je eden od procesov za pridobitev vinilklorida (sestavine PVC), ki nadomešča cenejše in bolj zapletene..
Hladilna tekočina
Končno se etan uporablja kot hladivo v skupnih kriogenih sistemih, kar kaže tudi zmožnost zamrzovanja majhnih vzorcev v laboratoriju za analizo..
Je zelo dober nadomestek za vodo, ki traja dlje, da ohladi občutljive vzorce in lahko povzroči nastanek škodljivih ledenih kristalov..
Tveganja za etane
-Etan ima sposobnost vžiga, zlasti ko se veže z zrakom. Pri odstotkih od 3,0 do 12,5% prostornine etana v zraku se lahko tvori eksplozivna zmes.
-Lahko omeji kisik v zraku, v katerem se nahaja, in zato predstavlja dejavnik tveganja zadušitve za ljudi in živali, ki so prisotni in izpostavljeni..
-Etan v zamrznjeni tekoči obliki lahko močno opekline kožo, če pride v neposreden stik z njim, prav tako pa deluje kot kriogeni medij za vse predmete, ki jih dotakne, zamrzne v nekaj trenutkih..
-Hlapi tekočega etana so težji od zraka in so koncentrirani na tleh, kar lahko predstavlja tveganje za vžig, ki lahko povzroči reakcijo izgorevanja verige..
-Zaužitje etana lahko povzroči slabost, bruhanje in notranje krvavitve. Vdihavanje poleg zadušitve povzroča glavobol, zmedenost in nihanje razpoloženja. Smrt zaradi zastoja srca je možna pri visoki izpostavljenosti.
-Predstavlja toplogredni plin, ki skupaj z metanom in ogljikovim dioksidom prispeva k globalnemu segrevanju in podnebnim spremembam, ki jih povzroča onesnaževanje ljudi. Na srečo je manj obilno in trajno kot metan in absorbira manj sevanja kot to.
Reference
- Britannica, E. (s.f.). Etan. Vzpostavljeno iz britannica.com
- Nes, G. V. (s.f.). Enokristalne strukture in porazdelitve elektronske gostote etana, etilena in acetilena. Izterjano iz rug.nl
- Sites, G. (s.f.). Etan: viri in korita. Pridobljeno s spletnega mesta sites.google.com
- SoftSchools. (s.f.). Etanska formula. Izterjano iz softschools.com
- Wikipedija. (s.f.). Etan. Vzpostavljeno iz en.wikipedia.org


