Kemijska aktivacijska energija, iz katere je sestavljena, računanje
The kemijska aktivacijska energija (z vidika kinetičnih študij) se nanaša na najmanjšo možno količino energije, ki je potrebna za začetek kemične reakcije. Glede na teorijo trkov v kemijski kinetiki pravijo, da imajo vse molekule, ki so v gibanju, določeno količino kinetične energije..
To pomeni, da večja je hitrost vašega gibanja, večja je velikost vaše kinetične energije. V tem smislu se molekula, ki nosi hitro gibanje, sama po sebi ne more razdeliti na fragmente, zato se mora pojaviti trk med njo in drugo molekulo, tako da lahko pride do kemične reakcije..
Ko se to zgodi - ko pride do kolizije med molekulami - se del njene kinetične energije pretvori v vibracijsko energijo. Podobno, če je na začetku procesa kinetična energija visoka, bodo molekule, ki sodelujejo pri trku, predstavile tako veliko vibracijo, da bodo nekatere prisotne kemijske vezi razbite..
Ta prekinitev povezav je prvi korak pri preoblikovanju reaktantov v izdelke; to je v oblikovanju teh. Po drugi strani pa, če je na začetku tega procesa kinetična energija majhne velikosti, se bo pojavil fenomen "odboja" molekul, skozi katerega se bodo praktično nedotaknjene ločile..
Indeks
- 1 Kaj vsebuje??
- 1.1 Aktivirani kompleks
- 2 Kako se izračuna?
- 2.1 Izračun aktivacijske energije kemijske reakcije
- 3 Kako aktivacijska energija vpliva na hitrost reakcije?
- 4 Primeri izračuna aktivacijske energije
- 5 Reference
Od česa je sestavljen??
Iz koncepta trkov med molekulami za sprožitev prej opisanih kemijskih reakcij lahko rečemo, da obstaja minimalna količina energije, ki je potrebna za trčenje..
Torej, če je energijska vrednost manjša od tega nujnega minimuma, potem preprosto ne bo prišlo do spremembe med molekulami po tem, ko pride do trka, kar pomeni, da ko ta energija ni prisotna, zadevne vrste ostanejo praktično nepoškodovane in se ne bodo zgodile. spremembe zaradi tega šoka.
V tem vrstnem redu idej je minimalna energija, ki je potrebna za spremembo po trku med molekulami, imenovana aktivacijska energija.
Z drugimi besedami, molekule, ki sodelujejo v šoku, morajo imeti količino celotne kinetične energije z velikostjo, ki je enaka ali večja od aktivacijske energije, tako da lahko pride do kemične reakcije..
Prav tako v mnogih primerih molekule trčijo in izvirajo iz nove vrste, imenovane aktivirani kompleks, struktura, ki se imenuje tudi "prehodno stanje", ker obstaja le začasno..
Povzroča jo reaktantska vrsta zaradi trka in pred nastankom produktov reakcije.
Aktiviran kompleks
Omenjeni aktivirani kompleks tvori vrsto, ki ima zelo nizko stabilnost, ki pa ima veliko potencialne energije.
Naslednji diagram prikazuje pretvorbo reaktantov v produkte, izražene z energijo, in ugotavlja, da je energija aktiviranega kompleksa, ki nastane, bistveno večja od energije reaktantov in produktov..
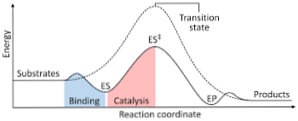
Če imajo proizvodi na koncu reakcije večjo stabilnost kot reaktantne snovi, se sproščanje energije odvija v obliki toplote, kar povzroči eksotermno reakcijo..
Nasprotno, če reaktanti povzročijo stabilnost večje velikosti od produktov, to pomeni, da reakcijska zmes kaže absorpcijo energije v obliki toplote iz okolice, kar povzroči endotermno reakcijo..
Podobno, če pride do enega ali drugega primera, je treba konstruirati diagram, kot je tisti, ki je bil prej prikazan, kjer se prikaže potencialna energija sistema, ki reagira proti napredovanju ali napredovanju reakcije..
Na ta način dobimo potencialne energetske spremembe, ki se zgodijo med reakcijo, in reaktante pretvorimo v produkte.
Kako se izračuna?
Aktivacijska energija kemijske reakcije je tesno povezana s konstanto hitrosti te reakcije in odvisnost te konstante od temperature predstavlja Arrheniusova enačba:
k = Ae-Ea / RT
V tem izrazu k predstavlja konstanto hitrosti reakcije (ki je odvisna od temperature) in parametra A imenuje se frekvenčni faktor in je merilo pogostosti trka med molekulami.
Za svoj del, e izraža osnovo serije naravnih logaritmov. Povišana je na moč, ki je enaka negativnemu količniku aktivacijske energije (Ea) med proizvodom, ki nastane s plinsko konstanto (R) in absolutno temperaturo (T) sistema, ki ga je treba upoštevati.
Treba je opozoriti, da se frekvenčni faktor lahko šteje za konstanto v nekaterih reakcijskih sistemih v širokem temperaturnem območju.
Ta matematični izraz je prvotno predvideval kemik nizozemskega porekla Jacobus Henricus van't Hoff leta 1884, ki pa mu je dal znanstveno veljavnost in razlagal njegovo predpostavko, da je leta 1889 švedski kemik Svante Arrhenius..
Izračun aktivacijske energije kemijske reakcije
Arrheniusova enačba opozarja na neposredno sorazmernost med konstanto hitrosti reakcije in pogostostjo spopadov med molekulami..
Prav tako lahko to enačbo predstavimo na bolj priročen način z uporabo lastnosti naravnih logaritmov na vsaki strani enačbe, pri čemer dobimo:
ln k = ln A - Ea / RT
Pri prerazporeditvi izrazov, da bi dobili enačbo vrstice (y = mx + b), se doseže naslednji izraz:
ln k = (- Ea / R) (1 / T) + ln A
Torej, pri gradnji grafa ln k v primerjavi z 1 / T dobimo ravno črto, kjer ln k predstavlja y koordinato, (- A / R) predstavlja naklon črte (m), (1 / T) predstavlja koordinato x in ln A predstavlja presečišče z osjo ordinat (b).
Kot je razvidno, je naklon, ki izhaja iz tega izračuna, enak vrednosti -Ea / R. To pomeni, da je treba, če želimo s pomočjo tega izraza pridobiti vrednost aktivacijske energije, izvesti preprosto čiščenje, kar ima za posledico:
Ea = -mR
Tukaj vemo, da je vrednost m in R konstanta, ki je enaka 8,314 J / K · mol.
Kako aktivacijska energija vpliva na hitrost reakcije?
Ko poskušamo ustvariti sliko aktivacijske energije, jo lahko obravnavamo kot oviro, ki ne dopušča reakcije med molekulami nižje energije..
Kot v skupni reakciji se zgodi, da je število molekul, ki lahko reagirajo, precej veliko, hitrost - in enakovredno, kinetična energija teh molekul - je lahko zelo spremenljiva..
Običajno se zgodi, da le majhna količina vseh molekul, ki doživijo trčenje - tiste, ki imajo večjo hitrost gibanja - predstavljajo dovolj kinetične energije, da lahko premagajo velikost aktivacijske energije. Torej so te molekule primerne in sposobne biti del reakcije.
V skladu z Arrheniusovo enačbo negativni predznak, ki je pred količnikom med aktivacijsko energijo in produktom plinske konstante z absolutno temperaturo, pomeni, da se konstanta hitrosti zmanjšuje, ker se povečuje energija aktivacije, kot tudi rast, ko se temperatura poveča.
Primeri izračuna aktivacijske energije
Da bi izračunali aktivacijsko energijo z izdelavo grafa, v skladu z Arrheniusovo enačbo, smo ugotovili, da so konstante hitrosti razgradnje acetaldehida merjene pri petih različnih temperaturah in želimo določiti energijo aktivacije. za reakcijo, ki je izražena kot: \ t
CH3CHO (g) → CH4(g) + CO (g)
Podatki petih meritev so naslednji:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Najprej, da bi rešili to neznano in določili energijo aktiviranja, moramo zgraditi graf ln k vs 1 / T (y vs x), da dobimo ravno črto in od tu vzamemo naklon in poiščemo vrednost Ea kot je razloženo.
S preoblikovanjem podatkov meritev po Arrheniusovi enačbi [ln k = (- Ea / R) (1 / T) + ln A] najdemo naslednje vrednosti za y in x:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Od teh vrednosti in s pomočjo matematičnega izračuna naklona - bodisi v računalniku ali kalkulatorju, z izrazom m = (Y)2-Y1) / (X2-X1) ali z metodo linearne regresije - dobimo, da je m = -Ea / R = -2.09 * 104 K. Torej:
Ea = (8,314 J / K · mol) (2,09 * 10)4 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Za določitev drugih energij aktivacije s pomočjo grafičnega načina izvedemo podoben postopek.
Reference
- Wikipedija. (s.f.). Aktivacijska energija. Vzpostavljeno iz en.wikipedia.org
- Chang, R. (2007). Kemija, 9. izdaja. Mehika: McGraw-Hill.
- Britannica, E. (s.f.). Aktivacijska energija. Vzpostavljeno iz britannica.com
- Moore, J. W. in Pearson, R. G. (1961). Kinetika in mehanizem. Vzpostavljeno iz books.google.co.ve
- Kaesche, H. (2003). Korozija kovin: fizikalno-kemijska načela in trenutni problemi. Vzpostavljeno iz books.google.co.ve


