Močni in šibki elektroliti, razlike, primeri
The elektroliti so snovi, ki proizvajajo električno prevodno raztopino, kadar se raztopijo v polarnem topilu, kot je voda. Raztopljeni elektrolit se loči na katione in anione, ki so dispergirani v omenjeni raztopini. Če se na raztopino uporabi električni potencial, se kationi prilepijo na elektrodo, ki ima obilico elektronov.
V nasprotju s tem se anioni v raztopini vežejo na električno pomanjkljivo elektrodo. Snov, ki se disociira v ione, pridobi sposobnost vodenja električne energije. Večina soli, kislin in topnih baz predstavlja elektrolite.
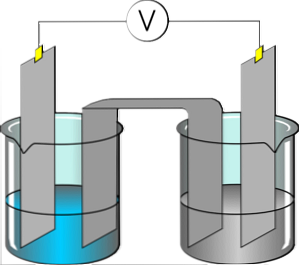
Nekateri plini, kot je vodikov klorid, lahko delujejo kot elektroliti pri določenih pogojih temperature in tlaka. Natrij, kalij, klorid, kalcij, magnezij in fosfat so dobri primeri elektrolitov.
Indeks
- 1 Kaj so močni in šibki elektroliti?
- 2 Razlike
- 3 Metode za identifikacijo elektrolitov
- 4 Primeri močnih in šibkih elektrolitov
- 4.1 Močni elektroliti
- 4.2 Šibki elektroliti
- 5 Reference
Kaj so močni in šibki elektroliti?
The močni elektroliti so tisti, ki popolnoma ionizirajo - to pomeni, da so 100% ločeni - medtem ko. \ t šibki elektroliti ionizirajo le delno. Ta odstotek ionizacije je običajno okoli 1 do 10%.
Za boljšo diferenciacijo teh dveh vrst elektrolitov lahko rečemo, da so v raztopini močnega elektrolita glavne vrste (ali vrste) nastali ioni, medtem ko je v šibki raztopini elektrolitov glavna vrsta sama spojina. ionizirajo.
Močni elektroliti so razdeljeni v tri kategorije: močne kisline, močne baze in soli; medtem ko so šibki elektroliti razdeljeni na šibke kisline in šibke baze.
Vse ionske spojine so močni elektroliti, ker se ločijo v ione, ko se raztopijo v vodi.
Celo najbolj netopne ionske spojine (AgCl, PbSO4, CaCO3) so močni elektroliti, ker majhne količine, ki se raztopijo v vodi, to počnejo predvsem v obliki ionov; to pomeni, da v nastali raztopini ni disociirane oblike ali količine spojine.
Ekvivalentna prevodnost elektrolitov se zmanjša pri višjih temperaturah, vendar se obnaša na različne načine, odvisno od njihove moči.
Močnejši elektroliti imajo nižjo prevodnost pri višjih koncentracijah, medtem ko imajo šibki elektroliti veliko zmanjšanje prevodnosti pri višjih koncentracijah..
Razlike
Pomembno je vedeti, kako prepoznati formulo in v kateri razvrstitvi jo prepoznati (ion ali spojina), ker bo to odvisno od varnostnih standardov pri delu s kemikalijami..
Kot je bilo že povedano, lahko elektrolite označimo kot močne ali šibke glede na njihovo ionizacijsko zmogljivost, vendar je to včasih lahko bolj očitno, kot se zdi..
Večina kislin, baz in topnih soli, ki ne predstavljajo kislin ali šibkih baz, veljajo za šibke elektrolite.
Dejansko je treba domnevati, da so vse soli močni elektroliti. Nasprotno šibke kisline in baze, poleg spojin, ki vsebujejo dušik, veljajo za šibke elektrolite.
Metode za identifikacijo elektrolitov
Obstajajo metode za lažjo identifikacijo elektrolitov. Nato se uporablja šeststopenjska metoda:
- Je vaš elektrolit ena od sedmih močnih kislin?
- Je v kovinski obliki (OH)n? Potem je močna osnova.
- Je v kovinski obliki (X)n? Potem je sol.
- Ali vaša formula začne s H? Potem je verjetno šibka kislina.
- Ali ima atom dušika? Potem je lahko šibka osnova.
- Nič od zgoraj navedenega ne velja? Potem ni elektrolit.
Prav tako, če reakcija, ki jo predstavlja elektrolit, izgleda takole: NaCl (s) → Na+(ac) + Cl-(ac), kjer je reakcija omejena z neposredno reakcijo (→), govorimo o močnem elektrolitu. V primeru, da je omejen s posrednim (↔), je šibek elektrolit.
Kot je navedeno v prejšnjem oddelku, se prevodnost elektrolita spreminja glede na koncentracijo tega v raztopini, vendar je tudi ta vrednost odvisna od jakosti elektrolita..
Pri višjih koncentracijah se močni in vmesni elektroliti ne bodo zmanjšali v pomembnih intervalih, toda šibki bodo predstavljali veliko zmanjšanje, dokler pri višjih koncentracijah ne dosežejo vrednosti blizu nič..
Obstajajo tudi vmesni elektroliti, ki se lahko raztopijo v raztopinah pri višjih odstotkih (manj kot 100%, vendar več kot 10%), poleg neelektrolitov, ki se preprosto ne ločijo (spojine ogljika, kot so sladkorji, maščobe in alkoholi)..

Primeri močnih in šibkih elektrolitov
Močni elektroliti
Močne kisline:
- Perklorna kislina (HClO)4)
- Bromovodikova kislina (HBr)
- Klorovodikova kislina (HCl)
- Žveplova kislina (H2SO4)
- Dušikova kislina (HNO)3)
- Periodična kislina (HIO)4)
- Fluoroantimonska kislina (HSbF)6)
- Čarobna kislina (SbF)5)
- Fluorosulfuric acid (FSO)3H)
Močne podlage
- Litijev hidroksid (LiOH)
- Natrijev hidroksid (NaOH)
- Kalijev hidroksid (KOH)
- Rubidijev hidroksid (RbOH)
- Cezijev hidroksid (CsOH)
- Kalcijev hidroksid (Ca (OH))2)
- Stroncijev hidroksid (Sr (OH))2)
- Barijev hidroksid (Ba (OH))2)
- Natrijev amid (NaNH)2)
Močna prodaja
- Natrijev klorid (NaCl)
- Kalijev nitrat (KNO)3)
- Magnezijev klorid (MgCl2)
- Natrijev acetat (CH3COONa)
Šibki elektroliti
Šibke kisline
- Ocetna kislina (CH3COOH)
- Benzojska kislina (C6H5COOH)
- Mravljinčna kislina (HCOOH)
- Vodikov cianid (HCN)
- Kloroocetna kislina (CH2ClOOH)
- Jodna kislina (HIO)3)
- Dušikova kislina (HNO2)
- Ogljikova kislina (H2CO3)
- Fosforjeva kislina (H3PO4)
- Žveplova kislina (H2SO3)
Šibke baze in dušikove spojine
- Dimetilamin ((CH3)2NH)
- Etilamin (C2H5NH2)
- Amoniak (NH3)
- Hidroksilamin (NH2OH)
- Piridin (C5H5N)
- Anilin (C6H5NH2)
Reference
- Močan elektrolit. Vzpostavljeno iz en.wikipedia.org
- Anne Helmenstine, P. (s.f.). Znanost o znanosti Vzpostavljeno iz sciencenotes.org
- OpenCourseWare. (s.f.). UMass Boston. Vzpostavljeno iz ocw.umb.edu
- Chemistry, D. o. (s.f.). St Olaf College. Vzpostavljeno iz stolaf.edu
- Anne Marie Helmenstine, P. (s.f.). ThoughtCo. Vzpostavljeno iz thoughtco.com


