Postopek elektrolize vode, tehnike, kaj je to, domači eksperiment
The elektroliza vode gre za razgradnjo vode v njene osnovne elemente z uporabo električnega toka. Pri prehodu se vodik in molekularni kisik tvorita na dveh inertnih površinah, H2 in O2. Ti dve površini sta bolje znani po imenu elektrod.
Teoretično, volumen H2 mora biti dvojni volumen O2. Zakaj? Ker ima vodna molekula razmerje H / O, ki je enako 2, to je dva H za vsak kisik. To razmerje je neposredno preverjeno s kemijsko formulo H2O. Vendar pa številni eksperimentalni dejavniki vplivajo na dobljene količine.

Če se elektroliza izvaja v ceveh, potopljenih v vodo (zgornja slika), vodni stolpec ustreza vodnemu stolpcu nižje višine, saj na površini tekočine deluje večja količina plina. Mehurčki obdajajo elektrode in se na koncu dvignejo, ko izteče parni tlak vode.
Upoštevajte, da so cevi med seboj ločene na tak način, da prihaja do majhne migracije plinov iz ene elektrode v drugo. Na nizkih lestvicah to ne predstavlja neposrednega tveganja; pri industrijskih tehtnicah pa plinska mešanica H2 in O2 Je zelo nevarno in eksplozivno.
Iz tega razloga so elektrokemične celice, kjer poteka elektroliza vode, zelo drage; potrebujejo zasnovo in elemente, ki zagotavljajo, da se plini nikoli ne mešajo, dobičkonosna trenutna oskrba, visoke koncentracije elektrolitov, posebne elektrode (elektrokatalizatorji) in mehanizmi za shranjevanje H2 proizvedene.
Elektrokatalizatorji predstavljajo trenje in hkrati krila za donosnost elektrolize vode. Nekateri so sestavljeni iz oksidov plemenitih kovin, kot so platina in iridij, katerih cene so zelo visoke. Prav na tej točki raziskovalci združujejo moči za oblikovanje učinkovitih, stabilnih in poceni elektrod.
Razlog za ta prizadevanja je pospešiti nastanek O2, ki je podan pri nižjih hitrostih v primerjavi s H2. To upočasnjuje elektroda, kjer nastane O2 kot splošna posledica prinaša uporabo potenciala, ki je veliko večji od potrebnega (čezmerni potencial); enakega, nižje uspešnosti in višjih stroškov.
Indeks
- 1 Reakcija elektrolize
- 1.1 Pol-celične reakcije
- 2 Postopek
- 3 Tehnike
- 3.1 Elektroliza z alkalno vodo
- 3.2 Elektroliza s polimerno elektrolitsko membrano
- 3.3 Elektroliza s trdnimi oksidi
- 4 Kakšna je uporaba elektrolize vode??
- 4.1 Proizvodnja vodika in njegove uporabe
- 4.2 Kot metoda za odpravljanje napak
- 4.3 Kot oskrba s kisikom
- 5 Domači eksperiment
- 5.1 Domače spremenljivke
- 6 Reference
Reakcija elektrolize
Elektroliza vode vključuje številne kompleksne vidike. Vendar pa je njena podlaga na splošno v preprosti globalni reakciji:
2H2O (1) => 2H2(g) + O2(g)
Kot smo opazili v enačbi, posredujeta dve vodni molekuli: ena mora biti običajno zmanjšana ali pridobiti elektrone, druga pa mora oksidirati ali izgubiti elektrone..
H2 Je produkt redukcije vode, ker dobiček elektronov pospešuje protone H+ lahko kovalentno vežemo in kisik pretvorimo v OH-. Zato je H2 pojavlja se na katodi, ki je elektroda, kjer pride do zmanjšanja.
Medtem ko je O2 prihaja iz oksidacije vode, ker izgublja elektrone, ki ji omogočajo, da se veže na vodik, in posledično sprosti protone H+. O2 pride do anode, elektrode, kjer pride do oksidacije; in za razliko od druge elektrode, je pH okrog anode kisel in ni bazičen.
Pol-celične reakcije
Zgornje je mogoče povzeti z naslednjimi kemijskimi enačbami za polk celične reakcije:
2H2O + 2e- => H2 + 2OH- (Katoda, osnovna)
2H2O => O2 + 4H+ + 4e- (Anoda, kislina)
Vendar voda ne more izgubiti več elektronov (4e-) katere druge molekule vode zmagajo na katodi (2e-); zato je treba prvo enačbo pomnožiti z 2 in nato odšteti z drugo enačbo, da dobimo neto enačbo:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + O2 + 4H+ + 4OH-
Toda 4H+ in 4OH- tvorijo 4H2Ali pa tako odstranimo štiri od šestih molekul H2Ali pa zapustitev dveh; in rezultat je pravkar postavljena globalna reakcija.
Reakcije pol-celic se spreminjajo s pH-vrednostmi, tehnikami in imajo potencialne potencialne redukcije ali oksidacijske potenciale, ki določajo, koliko toka je treba zagotoviti, da se elektroliza vode spontano nadaljuje..
Postopek
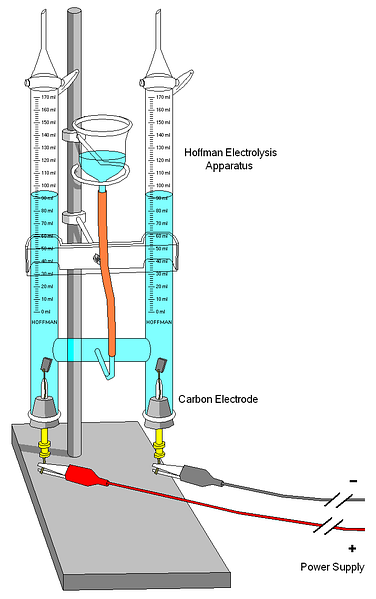
Zgornja slika prikazuje Hoffmanov voltmeter. Valji so napolnjeni z vodo in izbranimi elektroliti skozi srednjo šobo. Vloga teh elektrolitov je povečanje prevodnosti vode, saj je v normalnih pogojih zelo malo H ionov3O+ in OH- izdelkov vaše avto ionizacije.
Obe elektrodi sta ponavadi platina, čeprav sta bili na sliki zamenjani z ogljikovimi elektrodami. Oba sta povezana z baterijo, s katero se uporabi potencialna razlika (ΔV), ki pospešuje oksidacijo vode (tvorba O).2).
Elektroni potujejo skozi celotno vezje, dokler ne dosežete druge elektrode, kjer zmaga voda in postane H2 in OH-. Na tej točki sta že definirana anoda in katoda, ki ju je mogoče razlikovati po višini vodnih stebrov; tisti z manjšo višino, ustreza katodi, kjer nastane H2.
V zgornjem delu je nekaj ključev, ki omogočajo sproščanje nastalih plinov. Previdno lahko preverite prisotnost H2 s tem, da reagira s plamenom, katerega zgorevanje proizvaja plinasto vodo.
Tehnike
Tehnike elektrolize vode se razlikujejo glede na količino H2 in O2 ki se predlaga za ustvarjanje. Oba plina sta zelo nevarna, če sta pomešana skupaj, zato elektrolitske celice nosijo kompleksne zasnove za zmanjšanje povečanja plinastih tlakov in njihove difuzije skozi vodni medij..
Tudi tehnike nihajo, odvisno od celice, elektrolita, dodanega vodi, in samih elektrod. Po drugi strani pa nekateri implicirajo, da se reakcija izvaja pri višjih temperaturah, zmanjšuje porabo električne energije, drugi pa uporabljajo ogromne pritiske za vzdrževanje H2 shranjene.
Med vsemi tehnikami lahko omenimo naslednje tri:
Elektroliza z alkalno vodo
Elektrolizo izvedemo z bazičnimi raztopinami alkalijskih kovin (KOH ali NaOH). Pri tej tehniki se pojavijo reakcije: \ t
4H2O (l) + 4e- => 2H2(g) + 4OH-(ac)
4OH-(ac) => O2(g) + 2H2O (l) + 4e-
Kot je razvidno, tako na katodi kot na anodi, ima voda bazni pH; in poleg tega, OH- migrirajte do anode, kjer se oksidirajo do O2.
Elektroliza s polimerno elektrolitsko membrano
Pri tej tehniki se uporablja trdni polimer, ki služi kot prepustna membrana za H+, vendar nepremočljiva za pline. To zagotavlja večjo varnost med elektrolizo.
Pol-celične reakcije v tem primeru so:
4H+(ac) + 4e- => 2H2(g)
2H2O (l) => O2(g) + 4H+(ac) + 4e-
H ioni+ migrirajo iz anode na katodo, kjer se zmanjšajo na H2.
Elektroliza s trdnimi oksidi
Zelo drugačen od drugih tehnik uporablja okside kot elektrolite, ki pri visokih temperaturah (600-900 ° C) delujejo kot anionski transportni medij.2-.
Reakcije so:
2H2O (g) + 4e- => 2H2(g) + 202-
202- => O2(g) + 4e-
Upoštevajte, da so tokrat oksidi anioni, OR2-, tiste, ki potujejo do anode.
Kaj je uporaba elektrolize vode?
Elektroliza vode proizvaja H2 (g) in O2 (g) Približno 5% vodikovega plina, proizvedenega v svetu, se proizvaja z elektrolizo vode.
H2 je stranski produkt elektrolize vodnih raztopin NaCl. Prisotnost soli olajša elektrolizo s povečanjem električne prevodnosti vode.
Globalni odziv, ki se dogaja, je:
2NaCl + 2H2O => Cl2 + H2 + 2NaOH
Da bi razumeli velik pomen te reakcije, bodo omenjene nekatere uporabe plinastih produktov; ker so na koncu tiste, ki spodbujajo razvoj novih metod za učinkovitejšo in zeleno elektrolizo vode..
Od vseh je najbolj zaželena služiti kot celice, ki energično nadomeščajo uporabo gorečih fosilnih goriv.
Proizvodnja vodika in njegove uporabe
-Vodik, proizveden v elektrolizi, se lahko uporablja v kemični industriji, ki deluje v reakcijah odvisnosti, v procesih hidrogeniranja ali kot reducent v procesih redukcije..
-Prav tako je bistvenega pomena pri nekaterih dejavnostih komercialnega pomena, kot so: proizvodnja klorovodikove kisline, vodikov peroksid, hidroksilamini itd. Vpleten v sintezo amoniaka s katalitično reakcijo z dušikom.
-V kombinaciji s kisikom proizvaja plamene z visoko vsebnostjo kalorij, s temperaturami med 3.000 in 3.500 K. Te temperature se lahko uporabijo za rezanje in varjenje v kovinski industriji, za rastline sintetičnih kristalov, proizvodnjo kremena itd..
-Priprava vode: previsoke vsebnosti nitratov v vodi lahko zmanjšamo z njihovo odstranitvijo v bioreaktorje, v katerih bakterije kot vir energije uporabljajo vodik.
-Vodik posega v sintezo plastike, poliestra in najlona. Poleg tega je del proizvodnje stekla, ki povečuje izgorevanje med peko.
-Reagira z oksidi in kloridi mnogih kovin, med njimi srebro, baker, svinec, bizmut in živo srebro za proizvodnjo čistih kovin.
-Poleg tega se uporablja kot gorivo v kromatografskih analizah z detektorjem plamena.
Kot metoda za odpravljanje napak
Elektrolizo raztopin natrijevega klorida uporabimo za prečiščevanje vode v bazenu. Med elektrolizo nastane vodik v katodi in klor (Cl2) na anodi. V tem primeru govorimo o elektrolizi kot klorinatorju soli.
Klor se raztopi v vodi in tvori hipoklorno kislino in natrijev hipoklorit. Hlorovodikova kislina in natrijev hipoklorit sterilizirata vodo.
Kot oskrba s kisikom
Elektroliza vode se uporablja tudi za pridobivanje kisika v Mednarodni vesoljski postaji, ki služi za vzdrževanje kisikove atmosfere v postaji.
Vodik se lahko uporablja v gorivni celici, metoda za shranjevanje energije in uporaba vode, ki nastane v celici, za porabo astronavtov.
Domači eksperiment
Poskusi elektrolize vode so bili izvedeni v laboratorijskih tehtnicah z Hoffmanovimi voltmetri, ali drugim sklopom, ki omogoča, da vsebuje vse potrebne elemente elektrokemijske celice.
Od vseh možnih sklopov in opreme je lahko najpreprostejša velika posoda za vodo, ki bo služila kot celica. Poleg tega morate imeti pri roki tudi kovinsko ali električno prevodno površino, ki deluje kot elektrode; enega za katodo, drugo za anodo.
V ta namen so lahko koristni tudi svinčniki z grafitnimi točkami, nabrusenimi na obeh koncih. In končno, majhna baterija in nekaj kablov, ki ga povezujejo z improviziranimi elektrodami.
Če to ni storjeno v prozorni posodi, nastajanja plinskih mehurčkov ni bilo mogoče oceniti.
Domače spremenljivke
Čeprav je elektroliza vode tema, ki vsebuje številne zanimive vidike za tiste, ki iščejo alternativne vire energije, je domači eksperiment lahko dolgočasen za otroke in druge gledalce..
Zato lahko uporabimo zadostno napetost za ustvarjanje nastanka H2 in O2 izmenjujejo nekatere spremenljivke in opažajo spremembe.
Prva je sprememba pH vrednosti vode, pri čemer se bodisi s kisom nakisali voda, bodisi Na2CO3 da jo rahlo povežete. Treba je spremeniti količino opazovanih mehurčkov.
Poleg tega se lahko isti poskus ponovi s hladno in toplo vodo. Na ta način bi bil predviden vpliv temperature na reakcijo.
Nazadnje, da bi bilo zbiranje podatkov nekoliko manj brezbarvno, lahko uporabite zelo razredčeno raztopino škrlatnega soka. Ta sok je osnovni kislinski indikator naravnega izvora.
Če jo dodamo v posodo z uvedenimi elektrodami, bomo opazili, da bo voda na anodi postala rožnata (kislina), medtem ko bo na katodi obarvanost rumena (osnovna).
Reference
- Wikipedija. (2018). Elektroliza vode. Vzpostavljeno iz: en.wikipedia.org
- Chaplin M. (16. november 2018). Elektroliza vode. Struktura vode in znanost. Vzpostavljeno iz: 1.lsbu.ac.uk
- Energetska učinkovitost in obnovljiva energija. (s.f.). Proizvodnja vodika: elektroliza. Vzpostavljeno iz: energy.gov
- Phys.org. (14. februar 2018). Visoko učinkovit in poceni katalizator za elektrolizo vode. Vzpostavljeno iz: phys.org
- Kemija LibreTexts. (18. junij 2015). Elektroliza vode. Vzpostavljeno iz: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. in S. Lewis N. (2016). Načela in izvedbe elektroliznih sistemov za cepljenje vode. Royal Society of Chemistry.
- Regenti Univerze v Minnesoti. (2018). Elektroliza vode 2. Univerza v Minnesoti. Vzpostavljeno iz: chem.umn.edu


