Zgodovina kalorimetra, deli, vrste in njihove značilnosti
The kalorimetra je naprava, ki se uporablja za merjenje spremembe temperature snovi (običajno vode) znane specifične toplote. Ta sprememba temperature je posledica toplote, ki se absorbira ali sprošča v procesu, ki se preučuje; kemikalijo, če gre za reakcijo, ali fizično, če je sestavljena iz spremembe faze ali stanja.
V laboratoriju je najenostavnejši kalorimeter, ki ga najdemo v skodelici kave. Uporablja se za merjenje absorbirane ali sproščene toplote pri konstantnem tlaku v vodni raztopini. Reakcije se izberejo tako, da se izogne posredovanju reagentov ali plinastih produktov.
 V eksotermni reakciji se lahko količina toplote, ki se sprosti, izračuna iz povečanja temperature kalorimetra in vodne raztopine:
V eksotermni reakciji se lahko količina toplote, ki se sprosti, izračuna iz povečanja temperature kalorimetra in vodne raztopine:
Količina toplote, ki se sprosti v reakciji = količina toplote, ki jo absorbira kalorimeter + količina toplote, ki jo absorbira raztopina
Količina toplote, ki jo absorbira kalorimeter, se imenuje kalorimetrična kalorična zmogljivost. To se določi z dobavo znane količine toplote kalorimetru z dano maso vode. Nato se izmeri povečanje temperature kalorimetra in raztopina, ki jo vsebuje.
S temi podatki in uporabo specifične toplote vode (4,18 J / g ° C) se lahko izračuna kalorična zmogljivost kalorimetra. Ta zmogljivost se imenuje tudi kalorimetrična konstanta.
Po drugi strani je toplota, ki jo pridobiva vodna raztopina, enaka m · ce · Δt. V formuli m = masa vode, ce = specifična toplota vode in Δt = sprememba temperature. Če vemo vse to, lahko izračunamo količino toplote, ki se sprosti z eksotermno reakcijo.
Indeks
- 1 Zgodovina kalorimetra
- 2 Deli
- 3 Vrste in njihove značilnosti
- 3.1 Skodelica kave
- 3.2 Kalorimetrična črpalka
- 3.3 Adijabatski kalorimeter
- 3.4 Izoperibolični kalorimeter
- 3.5 Pretočni kalorimetar
- 3.6 Kalorimeter za diferenčno dinamično kalorimetrijo
- 4 Aplikacije
- 4.1 V fizikalno kemiji
- 4.2 V bioloških sistemih
- 4.3 Kalorimetrska črpalka za kisik in kalorična moč
- 5 Reference
Zgodovina kalorimetra
Leta 1780 je francoski kemik A. L. Lavoisier, ki se je štel za enega od očetov kemije, uporabil morskega prašiča za merjenje proizvodnje toplote s svojim dihanjem..
Kako? Uporaba naprave, podobne kalorimetru. Toplota, ki jo je proizvedel morski prašiček, je bila dokazana s taljenjem snega, ki je obkrožal aparaturo.
Raziskovalci A. Lavoisier (1743-1794) in P. S. Laplace (1749-1827) so izdelali kalorimeter, ki je bil uporabljen za merjenje specifične toplote telesa s postopkom taljenja ledu..
Kalorimeter je bil sestavljen iz pocinkane cilindrične čaše, lakirane, držane s stojalom in notranje zaključene z lijakom. V notranjosti je bilo postavljeno drugo steklo, podobno prejšnji, s cevjo, ki je šla skozi zunanjo komoro in ki je bila opremljena s ključem. V notranjosti drugega stekla je bila mreža.
V to mrežo je bila postavljena bitje ali predmet, katerega specifično toploto smo želeli določiti. Led je bil nameščen v koncentričnih posodah, tako kot v košari.
Toplota, ki jo je ustvarilo telo, je absorbirala led, kar je povzročilo njeno fuzijo. In tekoči vodni produkt taljenja ledu je bil zbran, odpiranje ključa notranjega stekla.
In končno, tehtanje vode, masa staljenega ledu je bila znana.
Deli
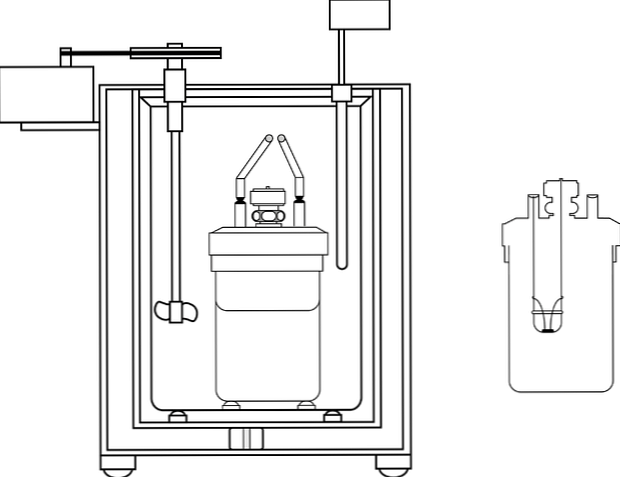
Najpogosteje uporabljen kalorimeter v laboratorijih za poučevanje kemije je tako imenovani kalorimeter skodelice za kavo. Ta kalorimeter je sestavljen iz čaše ali namesto vsebnika anime materiala, ki ima določene izolacijske lastnosti. V tej posodi se vodna raztopina namesti v telo, ki proizvaja ali absorbira toploto.
V zgornjem delu posode je nameščen pokrov izolacijskega materiala z dvema luknjama. V eni je uveden termometer za merjenje temperaturnih sprememb, v drugem pa mešalnik, prednostno iz steklenih materialov, ki opravlja funkcijo premikanja vsebnosti vodne raztopine..
Slika prikazuje dele kalorimetrične črpalke; Vendar pa je mogoče opaziti, da ima termometer in mešalo, skupne elemente v več kalorimetrih.
Vrste in njihove značilnosti
Skodelica kave
To je tista, ki se uporablja pri določanju toplote, ki se sprosti z eksotermno reakcijo, in toplota, ki se absorbira v endotermni reakciji.
Poleg tega se lahko uporablja pri določanju specifične toplote telesa; to je količina toplote, ki jo mora absorbirati gram snovi za dvig temperature za eno stopinjo Celzija. .
Kalorimetrična črpalka
Gre za napravo, v kateri se meri količina toplote, ki se sprosti ali absorbira v reakciji, ki se pojavi pri konstantni prostornini.
Reakcija poteka v močni jekleni posodi (črpalki), ki je potopljena v veliko količino vode. Zaradi tega so spremembe temperature vode majhne. Zato se predpostavlja, da se spremembe, povezane z reakcijo, merijo pri konstantni temperaturi in volumnu.
Zgoraj navedeno kaže, da se ne opravi nobeno delo, kadar se reakcija izvede v kalorimetrični črpalki.
Reakcija se začne z dobavo električne energije preko kablov, priključenih na črpalko.
Adijabatski kalorimeter
Zanj je značilna izolacijska struktura, ki se imenuje ščit. Ščit se nahaja okoli celice, kjer pride do spremembe toplote in temperature. Povezan je tudi z elektronskim sistemom, ki ohranja svojo temperaturo zelo blizu temperature celice, da se prepreči prenos toplote.
V adiabatnem kalorimetru je minimalna temperaturna razlika med kalorimetrom in okolico; kot tudi zmanjšanje koeficienta prenosa toplote in časa za izmenjavo toplote.
Njegovi deli so naslednji: \ t
-Celica (ali posoda), integrirana v izolacijski sistem, s katerim se skuša izogniti izgubi toplote.
-Termometer za merjenje temperaturnih sprememb.
-Grelec, priključen na krmiljen vir električne napetosti.
-In ščit, že omenjen.
V tej vrsti kalorimetra lahko določimo lastnosti, kot je entropija, debejeva temperatura in gostota elektronskega stanja.
Izoperibolični kalorimeter
To je naprava, v kateri so reakcijska celica in črpalka potopljeni v strukturo, imenovano jakna. V tem primeru je tako imenovana jakna sestavljena iz vode, ki se hrani na konstantni temperaturi.
Temperatura celice in črpalke naraščata, ko se med procesom izgorevanja sprosti toplota; vendar se temperatura vodnega plašča vzdržuje na fiksni temperaturi.
Mikroprocesor uravnava temperaturo celice in plašča, tako da izvede potrebne popravke toplotne izgube, ki je posledica razlik med obema temperaturama..
Ti popravki se uporabljajo neprekinjeno in s končnim popravkom na podlagi meritev pred preskusom in po njem.
Pretočni kalorimeter
Razvil ga je Caliendar in ima napravo za premikanje plina v posodo s konstantno hitrostjo. Pri dodajanju toplote se izmeri povečanje temperature v tekočini.
Tokovni kalorimetar je označen z:
- Natančno merjenje konstantnega pretoka.
- Natančno merjenje količine toplote, ki se vnese v tekočino skozi grelnik.
- Natančno merjenje povečanja temperature v plinu zaradi vnosa energije
- Zasnova za merjenje zmogljivosti plina pod pritiskom.
Kalorimeter za diferenčno dinamično kalorimetrijo
Zanj je značilno, da ima dva vsebnika: v enem je vzorec, ki ga je treba preučiti, drugi pa prazen ali da se uporabi referenčni material..
Oba plovila se s pomočjo dveh neodvisnih grelnikov ogrevata s konstantno energijsko hitrostjo. Ko se začne segrevanje obeh posod, bo računalnik prikazal razliko toplotnega toka grelnikov proti temperaturi in s tem določil pretok toplote..
Poleg tega je mogoče določiti spremembo temperature v odvisnosti od časa; in končno, zmogljivost kalorij.
Aplikacije
V fizikalno kemiji
-Osnovni kalorimetri, vrsta skodelice za kavo, omogočajo merjenje količine toplote, ki jo telo sprošča ali absorbira. Lahko določijo, ali je reakcija eksotermna ali endotermna. Poleg tega se lahko določi specifična toplota telesa.
-Z adiabatnim kalorimetrom je bilo mogoče določiti entropijo kemijskega procesa in elektronsko gostoto stanja..
V bioloških sistemih
-Mikrokalorimetri se uporabljajo za preučevanje bioloških sistemov, ki vključujejo interakcije med molekulami in molekularne konformacijske spremembe, ki se pojavljajo; na primer pri razvijanju molekule. Linija vključuje tako diferencialno skeniranje kot izotermično titracijo.
-Mikrokalorimeter se uporablja pri razvoju zdravil malih molekul, bioterapevtov in cepiv.
Kalorimeter in kalorična moč črpalke za kisik
Zgorevanje številnih snovi poteka v kalorimetru kislinske črpalke, njegova kalorična moč pa se lahko določi. Med snovmi, ki se preučujejo z uporabo tega kalorimetra, so: premog in koks; jedilna olja, težka in lahka; bencina in vseh motornih goriv.
Kot tudi vrste goriv za letalske reaktorje; odpadki in odlaganje odpadkov; prehrambeni izdelki in dodatki za prehrano ljudi; krmne rastline in dodatki za živalsko krmo; Gradbeni materiali; raketna in pogonska goriva.
Prav tako je kalorična moč določena s kalorimetrijo v termodinamičnih študijah gorljivih materialov; pri proučevanju energetske bilance v ekologiji; v eksplozivih in toplotnih prahih ter pri poučevanju osnovnih termodinamičnih metod.
Reference
- Whitten, Davis, Peck & Stanley. Kemija (8. izd.). CENGAGE Učenje.
- González J., Cortés L. in Sánchez A. (s.f.). Adiabatna kalorimetrija in njene uporabe. Izterjano iz: cenam.mx
- Wikipedija. (2018). Kalorimeter. Vzpostavljeno iz: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. junij 2018). Definicija kalorimetra v kemiji. Vzpostavljeno iz: thoughtco.com
- Gillespie, Claire. (11. april 2018). Kako deluje kalorimeter? Sciencing. Vzpostavljeno iz: sciencing.com


