Področje študija in aplikacije kemije okolja
The kemija okolja Študira kemijske procese, ki potekajo na okoljski ravni. To je znanost, ki uporablja kemijska načela za preučevanje okoljske uspešnosti in vplivov, ki jih povzročajo človeške dejavnosti.
Poleg tega okoljska kemija načrtuje tehnike za preprečevanje, ublažitev in sanacijo obstoječe okoljske škode.
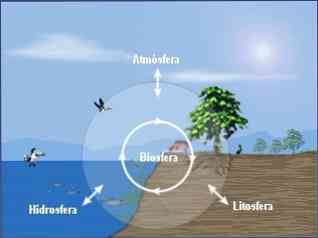
Okoljsko kemijo lahko razdelimo v tri osnovne discipline:
- Kemija okolja v atmosferi.
- Kemija okolja hidrosfere.
- Okoljska kemija tal.
Celovit pristop k kemiji okolja zahteva tudi preučevanje medsebojnih odnosov med kemijskimi procesi, ki se pojavljajo v teh treh predelih (atmosfera, hidrosfera, zemlja) in njihovi odnosi z biosfero..
Indeks
- 1 Kemija okolja v ozračju
- 1.1 -Stratosfera
- 1.2 -Troposfera
- 2 Kemija okolja hidrosfere
- 2.1 - Sveža voda
- 2.2 - Krog vode
- 2.3 - Antropološki vplivi na vodni krog
- 3 Okoljska kemija tal
- 3.1 Tla
- 3.2 Antropološki vplivi na tla
- 4 Kemijsko-okoljski odnosi
- 4.1 -Model Garrels in Lerman
- 5 Uporaba kemije okolja
- 6 Reference
Kemija okolja v atmosferi
Vzdušje je plast plinov, ki obdajajo Zemljo; gre za zelo kompleksen sistem, kjer se temperatura, tlak in kemična sestava spreminjajo z nadmorsko višino v zelo širokem razponu.
Sonce bombardira atmosfero s sevanjem in visoko energetskimi delci; to dejstvo ima zelo pomembne kemijske učinke v vseh slojih atmosfere, predvsem pa v najvišjih in zunanjih slojih.
-Stratosfera
V zunanjih predelih ozračja se pojavijo fotodisociacijske in fotionizacijske reakcije. V območju med 30 in 90 km v višini, merjeno od zemeljske površine, v stratosferi, se nahaja plast, ki vsebuje večinoma ozon (OR)3), ki se imenuje ozonski plašč.
Ozonski plašč
Ozon absorbira visoko energijsko ultravijolično sevanje, ki prihaja iz sonca in če ne zaradi obstoja te plasti, ni znanega načina življenja na planetu..
Leta 1995 so kemični kemiki Mario J. Molina (mehiški), Frank S. Rowland (ameriški) in Paul Crutzen (nizozemski) prejeli Nobelovo nagrado za kemijo za raziskave o uničevanju in izčrpavanju ozona v stratosferi..
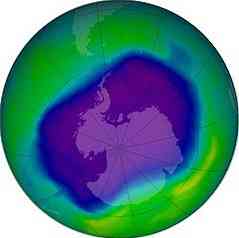
Leta 1970 je Crutzen pokazal, da dušikovi oksidi uničujejo ozon s katalitičnimi kemičnimi reakcijami. Potem so Molina in Rowland leta 1974 pokazali, da lahko klor klorofluoroogljikovih spojin (CFC) uniči ozonski plašč..
-Troposfera
Atmosferski sloj neposredno nad zemeljsko površino, visok med 0 in 12 km, imenovan troposfera, je sestavljen predvsem iz dušika (N)2in kisika (O2).
Strupeni plini
Zaradi človekovih dejavnosti troposfera vsebuje številne dodatne kemikalije, ki se štejejo za onesnaževala zraka, kot so:
- Dioksid in ogljikov monoksid (CO2 in CO).
- Metan (CH4).
- Dušikov oksid (NO).
- Žveplov dioksid (SO)2).
- Ozon O3 (šteje se za kontaminant v troposferi)
- Hlapne organske spojine (VOC), praški ali trdni delci.
Med številnimi drugimi snovmi, ki vplivajo na zdravje ljudi in rastlin ter živali.
Kisli dež
Žveplovi oksidi (SO2 in SO3) in dušikove, kot je dušikov oksid (NO2), povzroči drug okoljski problem, imenovan kisli dež.
Ti oksidi, prisotni v troposferi predvsem kot produkti zgorevanja fosilnih goriv v industrijskih dejavnostih in transportu, reagirajo z deževnico, ki proizvaja žveplovo kislino in dušikovo kislino..
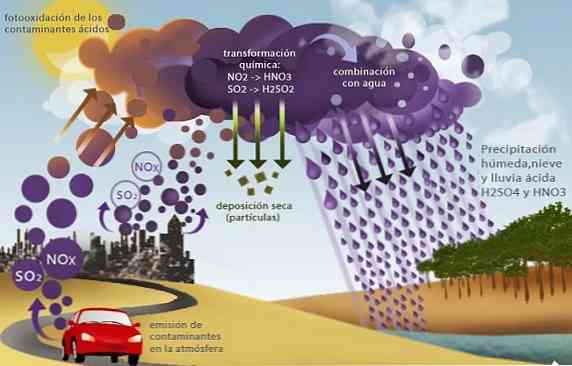
Z obarjanjem dežja, ki vsebuje močne kisline, sproži več okoljskih problemov, kot so zakisljevanje morja in svežih voda. To povzroča smrt vodnih organizmov; zakisljevanje tal, ki povzroči smrt pridelkov in uničenje s kemičnim korozivnim delovanjem stavb, mostov in spomenikov.
Druge atmosferske okoljske težave so fotokemični smog, ki ga povzročajo predvsem dušikovi oksidi in troposferski ozon
Globalno segrevanje
Globalno segrevanje povzročajo visoke koncentracije CO2 atmosferski in drugi toplogredni plini (GHG), ki absorbirajo velik del infrardečega sevanja, ki ga oddaja zemeljska površina in ujamejo toploto v troposferi. To ustvarja podnebne spremembe na planetu.
Kemija okolja hidrosfere
Hydrósfera je usklajena z vsemi vodnimi telesi Zemlje: površnimi ali humedale - oceani, jezera, reke, izviri - in pod zemljo ali vodonosniki.
-Sveža voda
Voda je najpogostejša tekoča snov na planetu, pokriva 75% zemeljske površine in je nujno potrebna za življenje.
Vse oblike življenja so odvisne od sladke vode (opredeljene kot voda z vsebnostjo soli, ki je manjša od 0,01%). 97% vode na planetu je slana voda.
Od preostalih 3% sveže vode je 87% v:
- Pole Zemlje (ki se zaradi globalnega segrevanja talijo in polivajo v morja).
- Ledeniki (tudi v procesu izginjanja).
- Podzemna voda.
- Voda v obliki pare, prisotna v atmosferi.
Za porabo je na voljo le 0,4% sveže vode na planetu. Izhlapevanje vode iz oceanov in padavine deževja stalno zagotavljajo ta majhen odstotek.
Kemija okolja v vodi preučuje kemijske procese, ki se pojavljajo v vodnem ciklu ali hidrološkem ciklu, ter razvija tehnologije za čiščenje vode za prehrano ljudi, obdelavo industrijskih in mestnih odpadnih voda, razsoljevanje morske vode, recikliranje. in shranjevanje tega vira med drugim.
-Vodni krog
Vodni cikel na Zemlji je sestavljen iz treh glavnih procesov: izhlapevanja, kondenzacije in padavin, od katerih so izpeljana tri vezja:
- Površinsko odtekanje
- Evapotranspiracija rastlin
- Infiltracija, v kateri voda prehaja v podzemne nivoje (podzemne vode), kroži po vodonosnih kanalih in izstopa prek izvirov, izvirov ali vodnjakov.
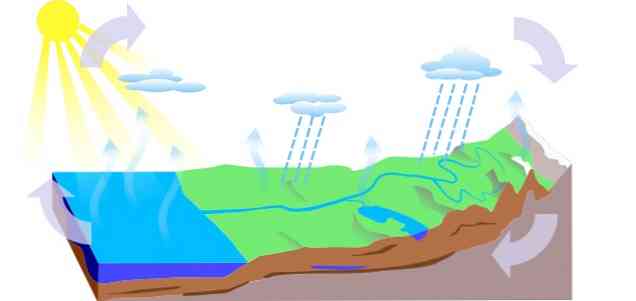
-Antropološki vplivi na vodni krog
Človeška dejavnost vpliva na vodni krog; Nekateri vzroki in učinki antropološkega delovanja so naslednji:
Sprememba kopenske površine
Nastane z uničenjem gozdov in polji z krčenjem gozdov. To vpliva na vodni krog z odpravljanjem evapotranspiracije (odvzem vode skozi rastline in vračanje v okolje s transpiracijo in izhlapevanjem) ter povečevanje odtoka..
Povečanje površinskega odtoka povzroča večji pretok reke in poplave.
Urbanizacija spreminja tudi površino kopnega in vpliva na vodni krog, saj je porozna zemlja nadomeščena s cementom in neprepustnim asfaltom, zaradi česar je infiltracija nemogoča..
Kontaminacija vodnega cikla
Vodni krog vključuje celotno biosfero, zato so odpadki, ki jih ustvarja človek, vključeni v ta cikel z različnimi procesi.
Kemična onesnaževala v zraku so vključena v dež. Agrokemikalije, ki se nanašajo na tla, se izcedujejo in prodirajo v vodonosnike ali odtekajo v reke, jezera in morja.
Tudi odpadke maščob in olj in izcedne vode odlagališč se vlečejo s infiltracijo v podzemno vodo.
Pridobivanje vodnih zalog z limiti v vodnih virih
Te prakse s prekoračitvijo, povzročajo izčrpavanje zalog podzemne vode in površinskih voda, vplivajo na ekosisteme in povzročajo lokalno zemljo..
Okoljska kemija tal
Tla so eden najpomembnejših dejavnikov v ravnovesju biosfere. Zagotavljajo sidrišče, vodo in hranila za rastline, ki so proizvajalci v zemeljskih trofičnih verigah.
Tla
Tla lahko opredelimo kot kompleksen in dinamičen ekosistem treh faz: trdno fazo mineralne in organske podpore, vodno tekočo fazo in plinsko fazo; značilne za določeno živalstvo in rastlinstvo (bakterije, glive, virusi, rastline, žuželke, ogorčice, \ t.
Lastnosti tal se stalno spreminjajo zaradi okoljskih razmer in biološke aktivnosti, ki se v njej razvija..
Antropološki vplivi na tla
Degradacija tal je proces, ki zmanjšuje proizvodno zmogljivost tal, ki lahko povzroči globoke in negativne spremembe v ekosistemu..
Dejavniki, ki povzročajo degradacijo tal, so: podnebje, fiziografija, litologija, vegetacija in človeško delovanje.

S človeškim delovanjem se lahko pojavijo:
- Fizična degradacija tal (na primer zbijanje zaradi neustreznih pridelovalnih in živinorejskih praks).
- Kemična razgradnja tal (zakisljevanje, alkaliziranje, zasoljevanje, kontaminacija s kemikalijami, odplake iz industrijske in mestne dejavnosti, razlitje nafte, med drugim).
- Biološka degradacija tal (zmanjšanje vsebnosti organske snovi, degradacija vegetacijskega pokrova, izguba med drugim mikroorganizmov, ki določajo dušik).
Kemijsko-okoljski odnosi
Okoljska kemija preučuje različne kemijske procese, ki potekajo v treh okoljih: atmosferi, hidrosferi in zemlji. Zanimivo je preučiti dodaten poudarek na preprostem kemijskem modelu, ki poskuša pojasniti globalne prenose snovi, ki se pojavljajo v okolju.
-Model Garrels in Lerman
Garrels in Lerman (1981) sta razvila poenostavljen model biogeokemije Zemljine površine, ki preučuje interakcije med atmosfero, hidrosfero, zemeljsko skorjo in biosfernimi predeli..
Model Garrelsa in Lermana obravnava sedem glavnih sestavin planeta:
- Mavec (CaSO4)
- Pirit (FeS2)
- Kalcijev karbonat (CaCO3)
- Magnezijev karbonat (MgCO3)
- Magnezijev silikat (MgSiO3)
- Železov oksid (Fe2O3)
- Silicijev dioksid (SiO)2)
Organska snov, ki sestavlja biosfero (živo in mrtvo), je predstavljena kot CH2Ali, kar je približna stehiometrična sestava živih tkiv.
V Garrelsovem in Lermanovem modelu so geološke spremembe proučene kot neto prenosi snovi med temi osmimi komponentami planeta, s kemijskimi reakcijami in neto ohranjevalno bilanco..
Kopičenje CO2 v ozračju
Na primer, problem kopičenja CO2 v atmosferi je raziskan v tem modelu, ki pravi, da: trenutno kurimo organski ogljik, shranjen v biosferi kot premog, nafto in zemeljski plin, odložen v podtalje v preteklih geoloških časih..
Zaradi intenzivnega sežiganja fosilnih goriv je koncentracija CO2 ozračje narašča.
Povečanje koncentracij CO2 v zemeljski atmosferi je to zato, ker stopnja zgorevanja fosilnega ogljika presega stopnjo absorpcije ogljika v drugih komponentah zemeljskega biogeokemičnega sistema (kot so fotosintetični organizmi in hidrosfera).
Na ta način se izpusti CO2 v ozračje zaradi človekovih dejavnosti, presega regulativni sistem, ki modulira spremembe na Zemlji.
Velikost biosfere
Model, ki so ga razvili Garrels in Lerman, prav tako meni, da se velikost biosfere povečuje in zmanjšuje zaradi ravnovesja med fotosintezo in dihanjem..
V zgodovini življenja na Zemlji se je masa biosfere postopoma povečevala z visoko stopnjo fotosinteze. To je povzročilo neto shranjevanje emisij organskega ogljika in kisika:
CO2 + H2O → CH2O + O2
Dihanje kot presnovna aktivnost mikroorganizmov in višjih živali pretvarja organski ogljik nazaj v ogljikov dioksid (CO2) in vodo (H2O), kar pomeni, da obrne prejšnjo kemijsko reakcijo.
Prisotnost vode, shranjevanje organskega ogljika in proizvodnja molekularnega kisika so bistveni za obstoj življenja.
Aplikacije kemije okolja
Kemija okolja ponuja rešitve za preprečevanje, ublažitev in sanacijo okoljske škode, ki jo povzroča človeška dejavnost. Med nekatere od teh rešitev lahko omenimo:
- Oblikovanje novih materialov, imenovanih MOF (za akronim v angleščini: Kovinski okviri). Te so zelo porozne in imajo sposobnost: absorbirati in zadržati CO2, dobite H2Ali zračne pare iz puščavskih območij in hranite H2 v majhnih posodah.
- Pretvorba odpadkov v surovine. Na primer, uporaba obrabljenih pnevmatik pri proizvodnji umetnih trav ali podplatov za čevlje. Tudi uporaba odpadkov za obrezovanje pridelkov, pri pridobivanju bioplina ali bioetanola.
- Kemična sinteza nadomestkov CFC.
- Razvoj alternativnih virov energije, kot so vodikove celice, za proizvodnjo čiste električne energije.
- Nadzor onesnaženosti zraka z inertnimi filtri in reaktivnimi filtri.
- Razsoljevanje morske vode z obratno osmozo.
- Razvoj novih materialov za flokulacijo koloidnih snovi, suspendiranih v vodi (postopek čiščenja).
- Povrnitev evtrofikacije jezer.
- Razvoj "zelene kemije", trend, ki predlaga zamenjavo strupenih kemičnih spojin z manj toksičnimi, in "okolju prijazne" kemijske postopke. Uporablja se na primer pri uporabi manj strupenih topil in surovin, v industriji, pri kemičnem čiščenju pralnic, med drugim..
Reference
- Calvert, J.G., Lazrus, A., Kok, G.L., Heikes, B.G., Walega, J.G., Lind, J., in Cantrell, C.A. (1985). Kemijski mehanizmi nastajanja kislin v troposferi. Nature, 317 (6032), 27-35. doi: 10.1038 / 317027a0.
- Crutzen, P.J. (1970). Vpliv dušikovih oksidov na atmosfersko vsebnost. Q.J.R. Metheorol. Soc. Wiley-Blackwell. 96: 320-325.
- Garrels, R.M. in Lerman, A. (1981). Fanerozojski cikli sedimentnega ogljika in žvepla. Zbornik Naravne akademije znanosti. ZDA 78: 4,652-4,656.
- Hester, R.E. in Harrison, R.M. (2002). Globalne okoljske spremembe. Royal Society of Chemistry. 205.
- Hites, R.A. (2007). Elementi okoljske kemije. Wiley-Interscience. 215.
- Manahan, S. E. (2000). Kemija okolja. Sedma izdaja. CRC str. 876
- Molina, M.J. in Rowland, F.S. (1974). Stratosfersko korito za klorofluorometane: klorirano katalizirano uničenje ozona. Narava 249: 810-812.
- Morel, F.M. in Hering, J.M. (2000). Načela in aplikacije vodne kemije. New York: John Wiley.
- Stockwell, W.R., Lawson, C.V., Saunders, E., in Goliff, W.S. (2011). Pregled troposferske atmosferske kemije in kemijskih mehanizmov plinske faze za modeliranje kakovosti zraka. Atmosfera, 3 (1), 1-32. doi: 10.3390 / atmos3010001


